题目内容
1.下列事实可证明NH3•H2O是弱碱的是( )| A. | 氨水能与氯化镁反应生成MgCl2溶液反应 | |
| B. | 氨气易溶于水 | |
| C. | 0.1摩尔/升的NH4Cl的pH值约为5 | |
| D. | 氨水可以使得酚酞试液变红 |
分析 要证明NH3•H2O是弱碱,只要说明NH3•H2O在水溶液中部分电离即可,可以根据一定物质的量浓度溶液pH、其强酸盐的酸碱性等知识判断.
解答 解:A.氨水能与氯化镁反应生成MgCl2溶液反应生成氢氧化镁沉淀,说明一水合氨是碱,但不能说明一水合氨部分电离,所以不能证明为弱电解质,故A错误;
B.氨气易溶于水,但不能说明一水合氨部分电离,所以不能证明一水合氨是弱电解质,故B错误;
C.0.1摩尔/升的NH4Cl的pH值约为5,说明NH4Cl是强酸弱碱盐,则能说明一水合氨是弱电解质,故C正确;
D.氨水可以使得酚酞试液变红,说明一水合氨电离出氢氧根离子而使溶液呈碱性,但不能说明一水合氨部分电离,所以不能证明一水合氨是弱电解质,故D错误;
故选C.
点评 本题考查弱电解质的判断,侧重考查学生分析判断能力,注意不能根据溶解性强弱、溶液导电能力强弱判断强弱电解质,要根据其电离程度判断,为易错题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是( )
| A. | 碘和氯化钾 | B. | 金刚石和冰晶石 | C. | 二氧化硅和干冰 | D. | 冰和冰醋酸 |
9.氢气可以在氧气中燃烧.在该反应中:断裂1mol H-H键消耗的能量为Q1kJ,断裂1mol O=O键消耗的能量为Q2kJ,形成1mol H-O键释放的能量为Q3 kJ.下列关系式中,正确的是( )
| A. | 2Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | 2Q1+Q2<4Q3 | D. | 2Q1+Q2<2Q3 |
16.铜~锌原电池如图所示,电解质溶液为稀硫酸,下列说法不正确的是( )
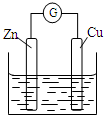

| A. | 铜电极上发生还原反应 | B. | 锌电极是原电池的负极 | ||
| C. | 电子从铜极经过外电路流向锌极 | D. | 锌电极上的反应为Zn-2e-═Zn2+ |
6.下列反应属于吸热反应的是( )
| A. | 金属镁与盐酸反应 | B. | 石灰石高温分解 | ||
| C. | 盐酸与氢氧化钠溶液反应 | D. | 二氧化硫和氧气生成三氧化硫 |
13.下列变化属于化学变化的是( )
| A. | 氨的液化 | B. | 氯化铵受热“升华” | ||
| C. | 碘的升华 | D. | 硝酸的挥发 |
10.下列说法中不正确的是( )
| A. | 19世纪中叶,门捷列夫的突出贡献是发现元素周期律 | |
| B. | 在金属和非金属元素交界处最容易找到半导体材料 | |
| C. | 在过渡元素中容易找到各种优良的催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 根据硼在元素周期表中的位置,推测硼的最高价含氧酸的化学式可能是HBO3 |
 ;物质⑤的结构式O=C=O.
;物质⑤的结构式O=C=O.