题目内容
3.已知:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)△H=+190kJ/mol.下列说法正确的是( )| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
分析 由热化学方程式可知正反应吸热,则反应物总能量小于生成物总能量,结合燃烧热的定义解答该题.
解答 解:A.甲醇燃烧应生成二氧化碳和水,该反应生成氢气,不能计算燃烧热,故A错误;
B.反应只能说明反应物总能量小于生成物总能量,不能确定CH3OH、H2能量的大小,则不能确定CH3OH、H2稳定性,故B错误;
C.反应热是在一定温度、压强下测定,与反应体系的温度和压强有关,故C错误;
D.因CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)△H=+190kJ/mol,则CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol,故D正确.
故选D.
点评 本题考查化学反应热能量,为高频考点,侧重于学生的分析能力的考查,注意知识的归纳和整理是解题的关键,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
13.在常温下,下列有关溶液中粒子的物质的量浓度的说法正确的是( )
| A. | 将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合后,若c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则a<b | |
| B. | 0.1mol•L-1NH4HS溶液中:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| C. | 若KHA溶液呈弱酸性,则c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中逐滴滴加等物质的量浓度的KCl和K2CrO4的混合溶液,若先产生白色沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
14.NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 常温下,2LpH=12的氨水中含有OH-数目为0.02NA | |
| B. | 氯碱工业中,外电路中转移电子数为0.3NA时产生气体体积(标准状况)为4.48L | |
| C. | 标准状况下,11.2LCH3Cl中非极性共价键数目等于2.0NA | |
| D. | 一定条件下,1molI2和0.2molH2混合充分反应,转移的电子数为0.4NA |
11.a、b、c、d四个金属电极,有关的实验装置现象如表所示:由此判断这四个电极对应的金属活动性由强到弱的顺序为
( )
( )
| 装置 | 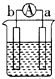 CuSO4溶液 | 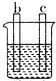 稀硫酸 |  稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
18.用铝热法还原下列化合物,当各制得1mol金属单质时,消耗铝的质量最少的是( )
| A. | CO3O4 | B. | WO3 | C. | MnO2 | D. | Cr2O3 |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA | |
| B. | 标准状况下,0.5 NA 个NO和0.5 NA 个O2混合气体的体积约为22.4 L | |
| C. | 一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA | |
| D. | 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA |

 ;
;