题目内容
12.为测定某镁铝合金样品(不含其它杂质)中镁的质量分数,某化学兴趣小组的同学设计了如下主要实验步骤:①粉碎:将镁铝合金样品粉碎,称得样品质量m1g
②溶解:将粉碎后的样品浸泡在过量NaOH溶液中溶解
③称重:过滤、洗涤、干燥,称得残渣质量m2g
④恒重:…
请回答下列问题:
(1)铝镁合金与过量NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)过滤时所需的玻璃仪器有玻璃棒、烧杯和普通漏斗;过滤时发现滤液中有少量浑浊,从实验操作的角度分析可能的原因的是滤纸破损,滤液高于滤纸边缘;(写两种原因);
(3)实验中,说明样品已经恒重的实验依据是重复②③操作,连续两次称量的结果相差不超过0.1g;
(4)实验中,测得镁铝合金样品中镁的质量分数为$\frac{100{m}_{2}}{{m}_{1}}$%;
(5)还可以通过测定反应生成气体的体积达到实验目的.请选用下列实验装置,设计一个最简单的实验测定m1g样品中镁的质量分数.
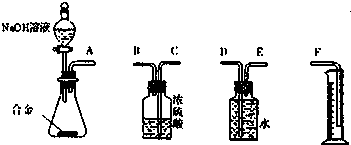
你认为装置的连接顺序是AEDF(填字母序号).
分析 (1)铝和氢氧化钠溶液反应生成偏氯酸钠和氢气,镁不与氢氧化钠溶液反应;
(2)过滤所需的玻璃仪器除玻璃棒外,还需要烧杯和漏斗;滤液中有少量浑浊,可能原因有:滤纸破损、漏斗中液面高于滤纸边缘等.
(3)样品已经恒重的实验依据是两次重复操作称量的质量相差不超过0.1g;
(4)镁铝合金样品中镁不与氢氧化钠溶液反应,铝和氢氧化钠溶液反应,所以过滤、洗涤、干燥,称得残渣质量m2g,据此计算;
(5)分析装置可知合金和氢氧化钠溶液反应生成的氢气可以利用排水量气法测定体积,来计算合金中铝的质量得到镁的质量分数.
解答 解:(1)铝镁合金与过量NaOH溶液反应,其中铝和氢氧化钠溶液反应生成偏氯酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)过滤操作中,所需的玻璃仪器除玻璃棒和烧杯外,还需要普通漏斗;若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因有:玻璃棒下端靠在滤纸的单层处,导致滤纸破损;漏斗中液面高于滤纸边缘等,
故答案为:普通漏斗;玻璃棒下端靠在滤纸的单层处,导致滤纸破损;漏斗中液面高于滤纸边缘;
(3)实验中,说明样品已经恒重的实验依据是,重复②③,实验步骤,②溶解:将粉碎后的样品浸泡在过量NaOH溶液中溶解
③称重:过滤、洗涤、干燥,称得残渣质量,两次称量的质 量相差不超过0.1g,
故答案为:重复②③操作,连续两次称量的结果相差不超过0.1g;
(4)镁铝合金样品中镁不与氢氧化钠溶液反应,铝和氢氧化钠溶液反应,所以过滤、洗涤、干燥,称得残渣质量m2g,合金中镁的质量分数=$\frac{{m}_{2}}{{m}_{1}}$×100%=$\frac{100{m}_{2}}{{m}_{1}}$%,
故答案为:$\frac{100{m}_{2}}{{m}_{1}}$%;
(5)合金和氢氧化钠溶液反应生成的氢气可以利用排水量气法测定体积,来计算合金中铝的质量得到镁的质量分数,装置连接顺序是AEDF,
故答案为:EDF.
点评 本题考查了混合物成分的实验测定方法和计算应用,主要是铝和镁性质的理解应用,掌握基础是解题关键,题目难度中等.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
H-H、O=O和O-H键的键能分别为436kJ•mol-1、a kJ•mol-1和462kJ•mol-1,
则a为( )
| A. | 496 | B. | 118 | C. | 350 | D. | 130 |
| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
| A. | 从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 | |
| B. | 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| C. | 等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 | |
| D. | 氧和硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
 (普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
(普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系) | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | D.不十分剧烈,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E.生成白色胶装沉淀,继而沉淀消失 |
(1)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、AlCl3溶液、NaOH溶液、酚酞溶液等,实验所用到的玻璃仪器:①胶头滴管、试管、烧杯、酒精灯以及玻璃片等.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A-E) | B |
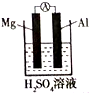
(4)该同学利用原电池原理也得出镁铝金属性的比较,他设计的原电池装置如图所示,其中正极发生的电极反应为:2H++2e-=H2↑.
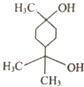
| A. | 4种 | B. | 5种 | C. | 8种 | D. | 9种 |
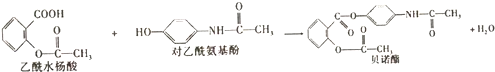
| A. | 根据有机物的分类,乙酰水杨酸也属于芳香烃 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 1mol乙酰水杨酸最多能与2molNaOH发生反应 |
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 近期媒体报道的某白酒中添加的塑化剂是对人体健康无害的物质 | |
| B. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“低碳经济”宗旨 | |
| C. | 大量二氧化碳气体的排放是形成酸雨的主要原因 | |
| D. | 使用太阳能、风能、潮汐能等能源能减少PM2.5的污染 |