题目内容
14.NA为阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 常温下,2LpH=12的氨水中含有OH-数目为0.02NA | |
| B. | 氯碱工业中,外电路中转移电子数为0.3NA时产生气体体积(标准状况)为4.48L | |
| C. | 标准状况下,11.2LCH3Cl中非极性共价键数目等于2.0NA | |
| D. | 一定条件下,1molI2和0.2molH2混合充分反应,转移的电子数为0.4NA |
分析 A.依据PH计算氢离子浓度,结合溶液中的离子积计算氢氧根离子浓度计算判断;
B.电解氯化钠溶液过程中,阳极生成氯气、阴极生成氢气,根据转移电子的量计算出生成气体的物质的量,再计算出标况下气体体积;
C.一氯甲烷分子中不存在非金属性共价键;
D.碘单质与氢气的反应为可逆反应,反应物不可能完全转化成生成物.
解答 解:A.常温下pH=12的氨水溶液中,氢离子浓度为10-12mol/L,氢氧根离子浓度为0.01mol/L,2L该溶液中含有0.02mol氢氧根离子,含有的OH-离子数为0.02NA,故A正确;
B.氯碱工业中,外电路中转移电子数为0.3NA,电子的物质的量为0.3mol,则阳极生成氯气的物质的量为:$\frac{0.3mol}{2}$=0.15mol,阴极生成氢气的物质的量为:$\frac{0.3mol}{2}$=0.15mol,两极总共生成0.3mol气体,产生气体体积(标准状况)为:22.4L/mol×0.3mol=6.72L,故B错误;
C.一氯甲烷中的共价键有碳氢键和碳氯键,都是极性键,不存在非极性键,故C错误;
D.1molI2和0.2molH2混合充分反应,该反应为可逆反应,生成的碘化氢一定小于0.4mol,转移的电子数小于0.4NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,涉及溶液pH的计算、电解原理的应用、共价键极性的判断、可逆反应特点等知识,试题知识点较多,充分考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
4.NA代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 10g D2O中含有的电子数为5 NA | |
| B. | 1mol C3H8分子中共价键总数为10 NA | |
| C. | 92g NO2和N2O4混合气体中含有原子数为3 NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
5.在一支25mL酸式滴定管中盛入0.1mol•L-1HCl溶液,其液面恰好在5mL刻度处;若把滴定管内溶液全部放入烧杯中,则烧杯中盐酸的体积( )
| A. | 大于20 mL | B. | 小于20 mL | C. | 等于20mL | D. | 等于5mL |
2.已知C(s)+H2O(g)═CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
H-H、O=O和O-H键的键能分别为436kJ•mol-1、a kJ•mol-1和462kJ•mol-1,
则a为( )
2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
H-H、O=O和O-H键的键能分别为436kJ•mol-1、a kJ•mol-1和462kJ•mol-1,
则a为( )
| A. | 496 | B. | 118 | C. | 350 | D. | 130 |
9.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 铁与稀盐酸反应: 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| B | 大理石溶于醋酸的反应: CaCO3+2H+═Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | FeCl3溶液“腐蚀”铜箔: Fe3++Cu═Fe2++Cu2+ | 正确 |
| D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | 错误,HCO3-也可以与OH-反应 |
| A. | A | B. | B | C. | C | D. | D |
19.化学无处不在,下列与化学有关的说法正确的是( )
| A. | 蛋白质、纤维素和油脂都属于天然高分子化合物 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 铁是人体必须的微量元素,所以要多吃含Fe3+的食物 | |
| D. | 生活中常见的酚醛树脂由苯酚和乙醛通过聚合反应得到 |
6.短周期元素X、Y、Z的原子序数依次递增,它们的原子最外层电子数之和为11,X、Z同主族,Y原子最外层电子数比X原子次外层电子数多1.下列叙述正确的是( )
| A. | Y的最高价氧化物的熔点比X的最高价氧化物的熔点低 | |
| B. | 原子半径:Y>Z>X | |
| C. | Y的最高价氧化物的水化物只能与酸反应,不能与碱反应 | |
| D. | 由Z、Y两元素分别形成的单质均存在同素异形体 |
3.已知:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)△H=+190kJ/mol.下列说法正确的是( )
| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
4.药物贝诺酯可由易酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述正确的是( )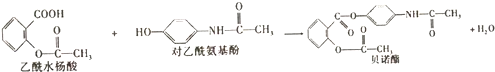

| A. | 根据有机物的分类,乙酰水杨酸也属于芳香烃 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 1mol乙酰水杨酸最多能与2molNaOH发生反应 |