题目内容
8.11.2L (标准状况)乙烯和甲烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后.溴的四氯化碳溶液的质量增加了8.4g.求原气体混合物中乙烯与甲烷的物质的量之比和质量比.分析 根据乙烯含有双键,能与溴水发生加成反应,乙烯和甲烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,再根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算物质的量、质量之比.
解答 解:11.2L混合气体的物质的量为:n=$\frac{11.2L}{22.4L/mol}$=0.5mol,
乙烯含有双键,能与溴水发生加成反应,乙烯和甲烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,则乙烯的物质的量为:n=$\frac{8.4g}{28g/mol}$=0.3mol,
则甲烷的物质的量为:0.5mol-0.3mol=0.2mol,质量为:0.2mol×16g/mol=3.2g,
所以乙烯与甲烷的物质的量之比为:0.3mol:0.2mol=3:2,质量之比为:8.4g:3.2g=21:8,
答:原气体混合物中乙烯与甲烷的物质的量之比为3:2,质量之比为21:8.
点评 本题考查混合物的计算,题目难度中等,明确乙烯与乙烷的性质差别是解题的关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积等物理量之间的转化关系.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| B. | 试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现 | |
| C. | 氢氧化钠沾到皮肤上,先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 | |
| D. | 为了减少实验误差,中和滴定用的锥形瓶必须洗净并烘干后使用 |
19.化学无处不在,下列与化学有关的说法正确的是( )
| A. | 蛋白质、纤维素和油脂都属于天然高分子化合物 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 铁是人体必须的微量元素,所以要多吃含Fe3+的食物 | |
| D. | 生活中常见的酚醛树脂由苯酚和乙醛通过聚合反应得到 |
16.如图表示a~g七种烃分子中4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,碳原子上其余的化学键都是与氢结合.下列说法正确的是( )


| A. | 只含4个碳原子的烃中,碳原子间的相互结合方式共有如图所示七种情况 | |
| B. | 以上七种物质均属于烷烃 | |
| C. | c和f分子的空间构型相同 | |
| D. | d与g互为同分异构体 |
3.已知:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)△H=+190kJ/mol.下列说法正确的是( )
| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
13.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:C2H4 | |
| B. | 水的电子式: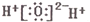 | |
| C. | 氯离子的结构示意图: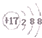 | |
| D. | 中子数为146,质子数为92的铀(U)原${\;}_{92}^{146}$U |
20.下列有关元素周期表和元素周期律的说法不正确的是( )
| A. | 从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 | |
| B. | 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| C. | 等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 | |
| D. | 氧和硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
17.松节油结构如图所示,在浓硫酸、加热条件下发生消去反应,最多可以生成几种有机产物( )
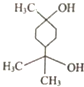

| A. | 4种 | B. | 5种 | C. | 8种 | D. | 9种 |
8.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下22.4L氯气通入足量水中反应,转移的电子数为NA | |
| B. | 乙烯和氮气组成的28g混合气体中含有NA个分子 | |
| C. | 1molNa2O2中阳离子和阴离子数均为2NA | |
| D. | 1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |