题目内容
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA | |
| B. | 标准状况下,0.5 NA 个NO和0.5 NA 个O2混合气体的体积约为22.4 L | |
| C. | 一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA | |
| D. | 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA |
分析 A、依据气体摩尔体积的应用条件分析判断,常温常压下的33.6 L氯气物质的量不是0.15mol;
B.一氧化氮与氧气反应生成二氧化氮,气体的物质的量减小;
C、氮气和氢气反应生成氨气是可逆反应不能进行彻底;
D、依据电解后溶液PH计算生成氢离子物质的量,结合化学方程式定量关系计算生成氧气物质的量得到分子数.
解答 解:A、氯气的物质的量不一定是1.5mol,所以无法计算电子转移数,故A错误;
B.0.5mol一氧化氮与0.25mol氧气反应生成0.25mol二氧化氮,导致气体的物质的量减小,反应后气体的体积小于22.4L,故B错误;
C、氮气和氢气反应生成氨气是可逆反应,一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目小于2NA,故C错误;
D、在电解CuSO4溶液的实验中,测得电解后溶液pH=0,c(H+)=1mol/L,又知电解后溶液体积为1 L,氢离子物质的量为1mol/L×1L=1mol,电解反应为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,在阳极析出的气体物质的量=0.25mol,分子数约为0.25NA ,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的应用,主要是气体摩尔体积的应用条件,混合物中的原子数目的计算,关键是概念的应用条件的分析理解,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.已知:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)△H=+190kJ/mol.下列说法正确的是( )
| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
4.药物贝诺酯可由易酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述正确的是( )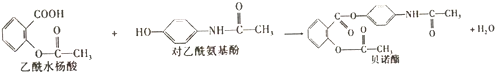

| A. | 根据有机物的分类,乙酰水杨酸也属于芳香烃 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 1mol乙酰水杨酸最多能与2molNaOH发生反应 |
1.分析下表中有机物的排列规律,可写出空格上物质的分子式,则横线上能与金属钠反应放出氢气的有机物有(不含立体异构)( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下22.4L氯气通入足量水中反应,转移的电子数为NA | |
| B. | 乙烯和氮气组成的28g混合气体中含有NA个分子 | |
| C. | 1molNa2O2中阳离子和阴离子数均为2NA | |
| D. | 1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
12.下列说法中正确的是( )
| A. | 近期媒体报道的某白酒中添加的塑化剂是对人体健康无害的物质 | |
| B. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“低碳经济”宗旨 | |
| C. | 大量二氧化碳气体的排放是形成酸雨的主要原因 | |
| D. | 使用太阳能、风能、潮汐能等能源能减少PM2.5的污染 |
13.下列说法错误的是( )
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸热反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=-△H2 |