题目内容
11.a、b、c、d四个金属电极,有关的实验装置现象如表所示:由此判断这四个电极对应的金属活动性由强到弱的顺序为( )
| 装置 | 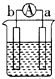 CuSO4溶液 | 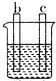 稀硫酸 |  稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
分析 在原电池中,一般来说,活泼金属作负极、较不活泼金属作正极,负极上金属失电子发生氧化反应、正极上得电子发生还原反应,电流从正极沿导线流向负极,据此分析解答.
解答 解:在原电池中,一般来说,活泼金属作负极、较不活泼金属作正极,负极上金属失电子发生氧化反应、正极上得电子发生还原反应,电流从正极沿导线流向负极,
第一个装置中,a极质量减小、b极质量增大,说明a极上金属失电子发生氧化反应、b电极上得电子发生还原反应,所以金属性a>b;
第二个装置中,b和稀硫酸反应生成氢气,说明b位于H元素之前,c极无明显现象,说明c位于H元素之后;
第三个装置中,电流从a流向d,则金属活动性d>a,
通过以上分析知,金属活动性强弱顺序是d>a>b>c,故选A.
点评 本题以原电池原理为载体考查金属活动性强弱判断,正确判断正负极是解本题关键,注意不能根据得失电子多少判断金属活动性强弱,要根据得失电子难易程度判断,题目难度不大.

练习册系列答案
相关题目
2.已知C(s)+H2O(g)═CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
H-H、O=O和O-H键的键能分别为436kJ•mol-1、a kJ•mol-1和462kJ•mol-1,
则a为( )
2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
H-H、O=O和O-H键的键能分别为436kJ•mol-1、a kJ•mol-1和462kJ•mol-1,
则a为( )
| A. | 496 | B. | 118 | C. | 350 | D. | 130 |
19.化学无处不在,下列与化学有关的说法正确的是( )
| A. | 蛋白质、纤维素和油脂都属于天然高分子化合物 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 铁是人体必须的微量元素,所以要多吃含Fe3+的食物 | |
| D. | 生活中常见的酚醛树脂由苯酚和乙醛通过聚合反应得到 |
6.短周期元素X、Y、Z的原子序数依次递增,它们的原子最外层电子数之和为11,X、Z同主族,Y原子最外层电子数比X原子次外层电子数多1.下列叙述正确的是( )
| A. | Y的最高价氧化物的熔点比X的最高价氧化物的熔点低 | |
| B. | 原子半径:Y>Z>X | |
| C. | Y的最高价氧化物的水化物只能与酸反应,不能与碱反应 | |
| D. | 由Z、Y两元素分别形成的单质均存在同素异形体 |
16.如图表示a~g七种烃分子中4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,碳原子上其余的化学键都是与氢结合.下列说法正确的是( )


| A. | 只含4个碳原子的烃中,碳原子间的相互结合方式共有如图所示七种情况 | |
| B. | 以上七种物质均属于烷烃 | |
| C. | c和f分子的空间构型相同 | |
| D. | d与g互为同分异构体 |
3.已知:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)△H=+190kJ/mol.下列说法正确的是( )
| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
20.下列有关元素周期表和元素周期律的说法不正确的是( )
| A. | 从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 | |
| B. | 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| C. | 等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 | |
| D. | 氧和硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
1.分析下表中有机物的排列规律,可写出空格上物质的分子式,则横线上能与金属钠反应放出氢气的有机物有(不含立体异构)( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 ;Z的电子式是
;Z的电子式是 .
.