题目内容
18.用铝热法还原下列化合物,当各制得1mol金属单质时,消耗铝的质量最少的是( )| A. | CO3O4 | B. | WO3 | C. | MnO2 | D. | Cr2O3 |
分析 生成金属均为1mol,金属元素的化合价变化的数值越小,说明发生氧化还原反应时得到的电子数目越少,则消耗铝的量最少.
解答 解:A.Co3O4中Co的平均化合价为+$\frac{8}{3}$;
B.WO3中W的化合价为+6;
C.MnO2中Mn的化合价为+4;
D.Cr2O3中Cr的化合价为+3;
A中Co元素化合价变化最小,根据电子转移守恒,故A中生成1molCo时,转移电子最少,则消耗Al最少,
故选A.
点评 本题考查氧化还原反应的计算,注意从化合价变化的角度判断,题目难度不大.

练习册系列答案
相关题目
9.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 铁与稀盐酸反应: 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| B | 大理石溶于醋酸的反应: CaCO3+2H+═Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | FeCl3溶液“腐蚀”铜箔: Fe3++Cu═Fe2++Cu2+ | 正确 |
| D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | 错误,HCO3-也可以与OH-反应 |
| A. | A | B. | B | C. | C | D. | D |
6.短周期元素X、Y、Z的原子序数依次递增,它们的原子最外层电子数之和为11,X、Z同主族,Y原子最外层电子数比X原子次外层电子数多1.下列叙述正确的是( )
| A. | Y的最高价氧化物的熔点比X的最高价氧化物的熔点低 | |
| B. | 原子半径:Y>Z>X | |
| C. | Y的最高价氧化物的水化物只能与酸反应,不能与碱反应 | |
| D. | 由Z、Y两元素分别形成的单质均存在同素异形体 |
13.下列说法不正确的是( )
| A. | 乙醇和乙酸均可与钠反应放出氢气 | |
| B. | 乙烯和苯均能使溴水褪色,且原理相同 | |
| C. | 等物质的量的正丁烷和异丁烷,含有非极性键的数目相同 | |
| D. | 甲烷在光照条件下与Cl2发生取代反应,共得到5种产物 |
3.已知:CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)△H=+190kJ/mol.下列说法正确的是( )
| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
10.下列冶炼金属的原理及方程式不正确的是( )
| A. | 工业冶炼铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 火法炼铜Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 工业冶炼镁MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2 | |
| D. | 工业冶炼铝Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al |
7.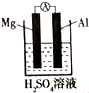 (普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
(普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
请你帮助该同学整理并完成实验报告:
(1)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、AlCl3溶液、NaOH溶液、酚酞溶液等,实验所用到的玻璃仪器:①胶头滴管、试管、烧杯、酒精灯以及玻璃片等.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
(3)此实验的结论:钠、镁、铝的金属性强弱顺序为Na>Mg>Al.
(4)该同学利用原电池原理也得出镁铝金属性的比较,他设计的原电池装置如图所示,其中正极发生的电极反应为:2H++2e-=H2↑.
 (普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
(普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系) | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | D.不十分剧烈,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E.生成白色胶装沉淀,继而沉淀消失 |
(1)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、AlCl3溶液、NaOH溶液、酚酞溶液等,实验所用到的玻璃仪器:①胶头滴管、试管、烧杯、酒精灯以及玻璃片等.
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A-E) | B |
(4)该同学利用原电池原理也得出镁铝金属性的比较,他设计的原电池装置如图所示,其中正极发生的电极反应为:2H++2e-=H2↑.
 .
. .
.