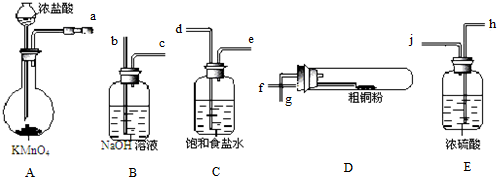
题目内容
13.常温下,在一定体积pH=13的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( )| A. | 1:9 | B. | 1:49 | C. | 1:99 | D. | 以上都不正确 |
分析 氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1反应,结合溶液的pH和溶液体积换算物质的量列式计算.
解答 解:pH=13的Ba(OH)2溶液中C(OH-)=10-1mol/L,设溶液体积为x,则含有的氢氧根离子物质的量为0.1xmol,含有的Ba2+的物质的量为0.05xmol,由于逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀,故反应的硫酸氢钠物质的量为:0.05xmol.
设硫酸氢钠溶液体积为y,依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,则反应后溶液中氢氧根离子浓度为10-3mol/L,
即:$\frac{0.1x-0.05x}{x+y}$=10-3,
整理可得:x:y=1:49,
故所加入的Ba(OH)2溶液与NaHSO4溶液体积之比是1:49.
故选B.
点评 本题考查了酸碱反应的综合计算、溶液pH的计算应用,题目难度中等,明确溶液中氢氧根离子浓度和溶质浓度的关系是解题关键,注意掌握溶液酸碱性与溶液pH的计算方法.

练习册系列答案
相关题目
3.下列说法中正确的是( )
| A. | 丙烯分子中有8个σ键,1个π键 | |
| B. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| C. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 | |
| D. | NCl3和BC13分子中,中心原子都采用sp3杂化 | |
| E. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
4.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol氢氧化铜后恰好恢复到电解前的浓度和pH.则电解过程中转移电子的物质的量为( )
| A. | 0.4mol | B. | 0.3 mol | C. | 0.2mol | D. | 0.1 mol |
5.Ⅰ.2011年11月28日至12月9日,联合国气候变化框架公约第17次缔约方会议在南非德班召开,随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:
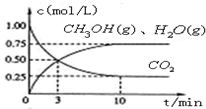
①写出该工业方法制取甲醇的化学反应方程式CO2+3H2?CH3OH+H2O.
②从反应开始到平衡,氢气的平均反应速率v (H2)=0.225mol•L-1•min-1.当温度降低时CO2的转化率变大,则该反应△H<0(填“>”“<”或“=”).
③下列措施中能使n(CH3OH)/n(CO2)增大的是C.
A.升高温度 B.充入氮气 C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为CH3OH-6 e-+8OH-=CO32-+6H2O.
Ⅱ:已知下列物质在20℃下的Ksp如下,试回答下列问题:
(1)20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl>AgBr>AgI>Ag2S.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Βρ-)}{c(Χλ-)}$=2.7×10-3.
(3)测定水体中氯化物含量,常用标准硝酸银法进行滴定,滴定时应加入的指示剂_D.
A.KBr B.KI C.K2S D.K2CrO4.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:

①写出该工业方法制取甲醇的化学反应方程式CO2+3H2?CH3OH+H2O.
②从反应开始到平衡,氢气的平均反应速率v (H2)=0.225mol•L-1•min-1.当温度降低时CO2的转化率变大,则该反应△H<0(填“>”“<”或“=”).
③下列措施中能使n(CH3OH)/n(CO2)增大的是C.
A.升高温度 B.充入氮气 C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为CH3OH-6 e-+8OH-=CO32-+6H2O.
Ⅱ:已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Βρ-)}{c(Χλ-)}$=2.7×10-3.
(3)测定水体中氯化物含量,常用标准硝酸银法进行滴定,滴定时应加入的指示剂_D.
A.KBr B.KI C.K2S D.K2CrO4.
 (或
(或 );;
);;