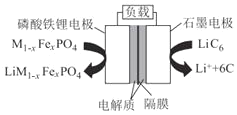
题目内容
【题目】下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
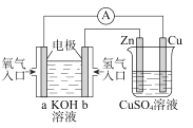
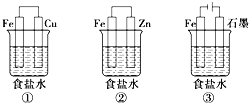
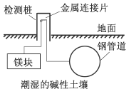
B.下图为埋在地下的钢管道采用牺牲阳极保护法防腐
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.马口铁(镀锡铁)镀层破损后,被腐蚀时首先是镀层被氧化
【答案】D
【解析】
A.生铁中含有碳,故生铁能发生电化学腐蚀,加快腐蚀速度,故生铁的抗腐蚀能力比纯铁弱,A正确;
B.下图为埋在地下的钢管道利用镁块比钢铁更活泼,故该方法是采用牺牲阳极的阴极保护法防腐,B正确;
C.金属在碱性电解质或中性介质或弱酸性介质中均发生吸氧腐蚀,只有在强酸性介质中才发生析氢腐蚀,故吸氧腐蚀比析氢腐蚀更普遍,C正确;
D.马口铁(镀锡铁)镀层破损后,由于铁比锡更活泼,被腐蚀时首先是铁层被氧化,D错误;
故答案为:D。

练习册系列答案
相关题目
【题目】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
Ⅰ | 977 | 0.28 | 0.56 | 0 | 0.4 |
Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
Ⅲ | 1250 | 0 | 0 | 0.56 | y |
A.达到平衡时,向容器Ⅰ中增加C(s)的量,平衡正向移动
B.x=0.8,y>0.4
C.达到平衡时,容器Ⅲ中的CO的转化率小于![]()
D.若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),则反应将向正反应方向进行