题目内容
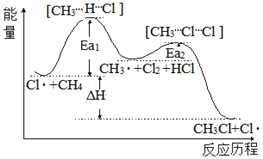
【题目】关于如图所示装置的判断,叙述正确的是( )
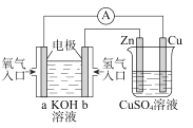
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.电子流向:Cu→经过CuSO4溶液→Zn→b
D.当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L
【答案】D
【解析】
根据图示装置可知,左侧装置为氢氧燃料电池,氢气为负极,发生氧化反应;氧气为正极,发生还原反应;右侧装置为电解池,铜与正极相连,为阳极,锌与负极相连,为阴极;据此进行分析。
A. 左边的装置是原电池,右边的装置是电解池,故A错误;
B. 左边是氢氧燃料电池,为原电池,通入氢气的电极是负极,通入氧气的电极是正极,则锌是阴极,铜是阳极,故B错误;
C. 左边是原电池,通入氢气的电极是负极,通入氧气的电极是正极,则锌是阴极,铜是阳极,装置中电子从b沿着导线流向Zn,电子从Cu沿着导线流向a,电子不进入电解质溶液,故C错误;
D. 根据转移电子守恒得![]() ,当铜片的质量变化为12.8g时,a极上消耗的O2在标况下体积为
,当铜片的质量变化为12.8g时,a极上消耗的O2在标况下体积为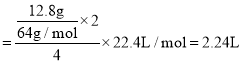 ,故D正确;
,故D正确;
答案选D。

【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ________________________________
(2)从开始至2min,Z的平均反应速率为 ________________
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ____________ 、 _______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 _________________ ,化学反应速率越大。