题目内容
【题目】用特殊电极材料制作的新型二次电池,放电时发生如下图所示的电极反应,下列说法正确的是
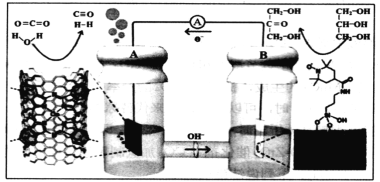
A.A为原电池的负极,失去电子,发生氧化反应
B.B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-=CH2OHCOCH2OH+2H+
C.若通过交换膜的离子是HCO![]() ,则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO
,则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO![]() =CH2OHCOCH2OH+2H2O+2CO2
=CH2OHCOCH2OH+2H2O+2CO2
D.若A处产生的CO和H2的物质的量之比为1:3,则B处消耗丙三醇的物质的量为4mol
【答案】C
【解析】
A.根据图中电子的移动方向,电子是由负极经导线流向正极的,故A为原电池的正极,得到电子,发生还原反应,A错误;
B.由于电解质是碱性条件,故B上发生的电极反应为CH2OH(CHOH)CH2OH=2e-+2OH-=CH2OHCOCH2OH+2H2O,B错误;
C.B电极上CH2OH(CHOH)CH2OH失电子后生成CH2OHCOCH2OH和H+,故若通过交换膜的离子是HCO![]() ,则HCO
,则HCO![]() 与H+反应,故则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO
与H+反应,故则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO![]() = CH2OHCOCH2OH+2H2O+2CO2,C正确;
= CH2OHCOCH2OH+2H2O+2CO2,C正确;
D.若A处产生的CO和H2的物质的量之比为1:3,并不知道产生的CO和H2的物质的量是多少,故无法计算B处消耗丙三醇的物质的量,D错误;
故答案为:C。

练习册系列答案
相关题目