��Ŀ����
13����ʢ�е�����ϡ���ᣨ����nmolHCl���ļס��������ձ��ֱ����������ƽ�����ߣ�������ƽ��ʹ��ƽ�ﵽƽ�⣮Ȼ���ڼס����ձ��зֱ�Ͷ��amol Mg��bmol Al��ַ�Ӧ����ƽ��Ȼ����ƽ�⣮��1�����ס������ձ��������������ס������߾������ֱ�Ϊ$\frac{11}{12}$ag��$\frac{8b}{9}$g��
��2�����ס����ձ���������꣬��������������ס������߲�����H2��������ȣ����ȡ�����ȡ������ɴ��Ƴ�a��b=32��33��
���� ��1��������Ӧ��Mg+2HCl=MgCl2+H2����2Al+6HCl=2AlCl3+3H2�������ס������ձ���������������ݷ���ʽ��������������������ס������߾�����Ϊ����������������������֮�
��2�����ס����ձ���������꣬����������������Hԭ���غ㣬��֪�ס������߲�����H2��������ȣ���Ӧ����ƽ�⣬��ס������߾�������ȣ�
��� �⣺��1�����ס������ձ��������������������ȫ��Ӧ����
Mg+2HCl=MgCl2+H2��
24 2
ag x
����x=$\frac{ag��2}{24}$=$\frac{a}{12}$g��������Ϊag-$\frac{a}{12}$g=$\frac{11}{12}$ag��
2Al+6HCl=2AlCl3+3H2��
54 6
bg y
����y=$\frac{bg��6}{54}$=$\frac{b}{9}$g��������Ϊbg-$\frac{b}{9}$g=$\frac{8b}{9}$g��
�ʴ�Ϊ��$\frac{11}{12}$a��$\frac{8b}{9}$��
��2�����ס����ձ���������꣬����������������Hԭ���غ㣬��֪�ס������߲�����H2��������ȣ���Ӧ����ƽ�⣬��ס������߾�������ȣ���$\frac{11}{12}$a=$\frac{8b}{9}$����a��b=32��33��
�ʴ�Ϊ����ȣ�32��33��
���� ���⿼�黯ѧ����ʽ���㣬�ѶȲ���1���п������ò��������㣬ע��Ի���֪ʶ���������գ�

| A�� | �����ʵ���MgCl2��Ba��OH��2��HCl��Һ��ϣ�Mg2++3OH-+H+�TMg��OH��2��+H2O | |
| B�� | ��ˮ���������C��OH-��=10-13mol/L����Һ�м������ۣ�2Al+6H+�T3H2��+2Al3+ | |
| C�� | ��������Һ�еμ�����HI��Һ��Fe3++3NO3-+12H++10I-�TFe2++5I2��+3NO��+6H2O | |
| D�� | ��Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO4-+6H++5H2O2�T2Mn2++5O2��+8H2O |
| A�� | ����������Һ����ˮԡ�ϼ��� | |
| B�� | �������������ɫʯ����Һ | |
| C�� | ������Ȼ������������ʵ�ˮ��Һ����������Ӧʵ�� | |
| D�� | �ȼ���������NaOH��Һ��Ȼ���������������ʵ�ˮ��Һ����������Ӧʵ�� |
| ���Ͽ�Ƭ | ||
| ���� | �۵� | �е� |
| SiCl4 | -70�� | 57.6�� |
| TiCl4 | -25�� | 136.5�� |
��2���������������Ʒֱ��������ˣ�
��3��д��TiCl4ˮ��Ļ�ѧ����ʽTiCl4+��x+2��H2O$\frac{\underline{\;����\;}}{\;}$TiO2•xH2O��+4HCl��
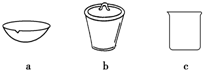
��4������ʵ�������������TiO2•xH2O����b������ĸ��ţ��м��ȣ�
��5���ݱ���������̬��·����������ʱ����һ������TiO2��TiO2��̫������������ĵ��ӱ�������ˮ�е�����ã�����H2O2��H2O2�����·������е�CxHy��CO�ȣ�����Ҫ��������H2O2�������ԣ�������ԡ���ԭ�ԡ�����
��6��ij�о�С��������װ��ģ�⡰��̬��·���IJ���ԭ�����ⶨCO��ת��Ч�ʣ��г�װ������ȥ����
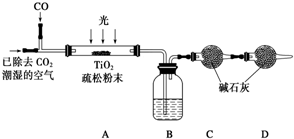
��Bװ���е�ҩƷ����ΪŨ���ᣬ��ͨ��2.24L��������ɱ�״����CO������������������ղ��װ��C��D����1.1g����CO��ת����Ϊ25%����ʵ����У���CO����ȫ��ͨ���Ҫ��ͨһ�����������Ŀ���DZ�֤��Ӧ���������ɵ�CO2ȫ������ʯ�����գ���Сʵ����
| A�� | NO2��ˮ�ķ�Ӧ��3NO2+H2O�T2H++2NO3-+NO | |
| B�� | ��NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH4++OH-$\frac{\underline{\;��\;}}{\;}$NH3��+H2O | |
| C�� | ������Һ��ˮ���е�CaCO3��Ӧ��2H++CaCO3�TCa2++H2O+CO2�� | |
| D�� | ��ϡ����ϴ���Թ��ڱڵ�������Ag+2H++NO3-�TAg++NO��+H2O |
 ��CH3CH�TCH2$��_{500��}^{Cl_{2}}$
��CH3CH�TCH2$��_{500��}^{Cl_{2}}$ ���������ϩ����
���������ϩ���� ��������ϩΪԭ�Ϻϳ�
��������ϩΪԭ�Ϻϳ�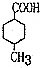 �����÷�Ӧ����ͼ��ʾ����ע����Ӧ������
�����÷�Ӧ����ͼ��ʾ����ע����Ӧ������