题目内容
5.已知:CH2═CH-CH═CH2+CH2═CH2→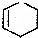 ,CH3CH═CH2$→_{500℃}^{Cl_{2}}$
,CH3CH═CH2$→_{500℃}^{Cl_{2}}$ .以异戊二烯(
.以异戊二烯(  ),丙烯为原料合成
),丙烯为原料合成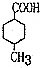 .(用反应流程图表示,并注明反应条件)
.(用反应流程图表示,并注明反应条件)
分析 根据题中信息,CH3CH═CH2$→_{500℃}^{Cl_{2}}$ ,将
,将 与CH2═CH-CH═CH2发生加成反应形成六元环,得到
与CH2═CH-CH═CH2发生加成反应形成六元环,得到 ,
, 与氢气发生加成反应得
与氢气发生加成反应得 ,
, 发生碱性水解得
发生碱性水解得 ,
, 经过两步氧化得
经过两步氧化得 ,据此答题;
,据此答题;
解答 解:根据题中信息,CH3CH═CH2$→_{500℃}^{Cl_{2}}$ ,将
,将 与CH2═CH-CH═CH2发生加成反应形成六元环,得到
与CH2═CH-CH═CH2发生加成反应形成六元环,得到 ,
, 与氢气发生加成反应得
与氢气发生加成反应得 ,
, 发生碱性水解得
发生碱性水解得 ,
, 经过两步氧化得
经过两步氧化得 ,合成路线为
,合成路线为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,题目难度中等,注意把握有机物的官能团的转化与性质,合理应用题中信息为解题的关键,注意有机基础知识的灵活运用.

练习册系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 苏打与稀盐酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2 溶液至SO42-刚好完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
16.某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4•5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:
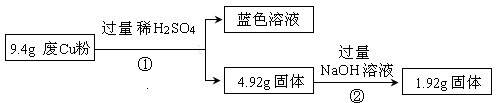
(1)废Cu粉中一定含有的杂质是Fe2O3、SiO2(填化学式)
(2)写出过程②发生反应的离子方程式:SiO2+2OH-═SiO32-+H2O.
过程Ⅱ:
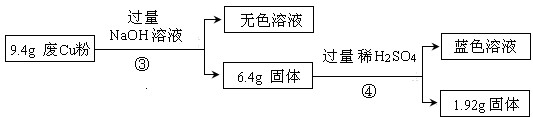
(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是m(Fe2O3):m(Cu):m(SiO2)=16:16:15(化为最简整数比)
过程Ⅲ:已知25℃时:
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2 溶液,调节溶液的pH范围为4.0≤pH<5.4,然后过滤、结晶,可得CuSO4•5H2O.
(5)下列与Ⅲ方案 相关的叙述中,正确的是ACD填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在.
过程Ⅰ:

(1)废Cu粉中一定含有的杂质是Fe2O3、SiO2(填化学式)
(2)写出过程②发生反应的离子方程式:SiO2+2OH-═SiO32-+H2O.
过程Ⅱ:

(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是m(Fe2O3):m(Cu):m(SiO2)=16:16:15(化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
(5)下列与Ⅲ方案 相关的叙述中,正确的是ACD填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在.
10.将浓硝酸分解的气体收集在一支试管中,再将试管倒插在水中,可能出现的现象是试管内液面上升,原因是:NO2和O2的混合气体溶于水使试管内压强减小,化学方程式为4NO2+O2+2H2O=4HNO3 .
3.下列各组溶液,不需要其他试剂就可以鉴别出来的是( )
| A. | AgNO3、NaCl、Na2SO4、NaI | B. | Na2SO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、NaCl、NaNO3 | D. | NaCl、HCl、NaAlO2、NaHCO3 |
4.将2.8g CO和0.2g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
| A. | 增加了3.0g | B. | 减少了3.0g | C. | 增加了2.6g | D. | 减少了2.6g |
 不能氧化为氧化成醛或酸
不能氧化为氧化成醛或酸
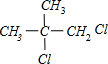 PMAA
PMAA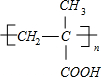
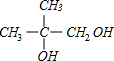 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2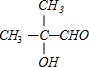 +2H2O;
+2H2O; $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.