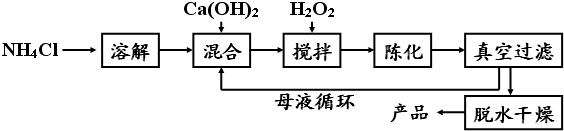
题目内容
11.纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.工业上以金红石(主要成分是TiO2,主要杂质是SiO2)制取纳米级二氧化钛的流程如下: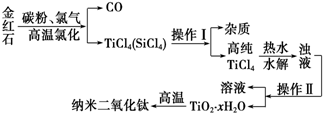
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
(2)操作Ⅰ、操作Ⅱ名称分别是蒸馏、过滤.
(3)写出TiCl4水解的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;加热\;}}{\;}$TiO2•xH2O↓+4HCl.
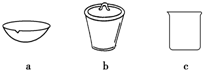
(4)如在实验室中完成灼烧TiO2•xH2O放在b(填字母序号)中加热.
(5)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的氧化性(填“氧化性”或“还原性”).
(6)某研究小组用下列装置模拟“生态马路”的部分原理并测定CO的转化效率(夹持装置已略去).
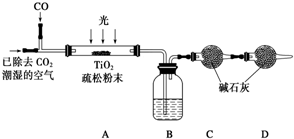
①B装置中的药品名称为浓硫酸,若通入2.24L(已折算成标准状况)CO气体和足量空气,最终测得装置C和D增重1.1g,则CO的转化率为25%.②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是保证反应过程中生成的CO2全部被碱石灰吸收,减小实验误差.
分析 本题是探究工业上以金红石(主要成分是TiO2,主要杂质是SiO2)制取纳米级二氧化钛的流程,涉及反应原理是先制备TiCl4,再利用TiCl4的水解制得TiO2,考查了实验的基本操作和混合物的分离提纯,并探究了CO转化率的计算;
(1)利用TiO2和碳粉、氯气在加热条件下生成TiCl4、CO,根据质量守恒即可写出此反应的化学方程式;
(2)根据资料卡片中的TiCl4与SiCl4熔点、沸点判断TiCl4与SiCl4在常温下的状态,分离沸点相差较大的互溶液体常采取蒸馏方法,从水溶液里分离出不溶性的固体,选择过滤操作分离;
(3)由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl;
(4)Ⅳ为高温分解固体物质,通常在坩埚中进行;
(5)CxHy、CO等具有还原性,H2O2具有强氧化性;
(6)①B装置的作用应该是干燥气体,防止水汽被碱石灰吸收,碱石灰增重11g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为$\frac{1.1g}{44g/mol}$=0.25mol,依据转化率概念计算得到;
②装置中有残留的二氧化碳气体,通一会空气的目的是赶净装置中 的二氧化碳被碱石灰吸收,减少测定误差.
解答 解:(1)在高温下,用氯气氧化TiO2的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
(2)TiCl4与SiCl4在常温下的液态混合物,相互混溶,可根据沸点差异选择蒸馏进行分离,操作Ⅱ可以通过过滤从水溶液里分离出不溶性的固体,故答案为:蒸馏;过滤;
(3)由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl,反应方程式为:TiCl4+(x+2)H2O$\frac{\underline{\;加热\;}}{\;}$TiO2•xH2O↓+4HCl,故答案为:TiCl4+(x+2)H2O$\frac{\underline{\;加热\;}}{\;}$TiO2•xH2O↓+4HCl;
(4)Ⅳ为烧杯与蒸发皿通常进行液态加热,高温分解固体物质常在坩埚中进行,所以b正确,故答案为:b;
(5)CxHy、CO等具有还原性,H2O2具有强氧化性,H2O2能氧化CxHy、CO等,清除路面空气中的CxHy、CO等,故答案为:氧化性;
(6)①B装置中可盛装浓硫酸干燥气体,22.4L(已折算成标准状况)CO气体的物质的量为:n(CO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
碱石灰增重11g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为:n(CO)=n(CO2)=$\frac{1.1g}{44g/mol}$=0.025mol,所以CO的转化率为$\frac{0.025mol}{0.1mol}$×100%=25%,故答案为:浓硫酸;25%;
②装置中有残留的CO2气体,通一会空气,将残留在装置中的CO2气体排出,以便被碱石灰吸收,从而减小误差,故答案为:保证反应过程中生成的CO2全部被碱石灰吸收,减小实验误差.
点评 本题考查学生阅读题目获取信息能力、物质分离提纯等基本操作、对实验原理装置的理解等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 14g聚乙烯中所含原子数为3NA | |
| B. | 48g 甲硫醇(CH4S)中含有C-H键数目为4NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 0.1mol苯乙烯中含有双键的数目为0.4NA |
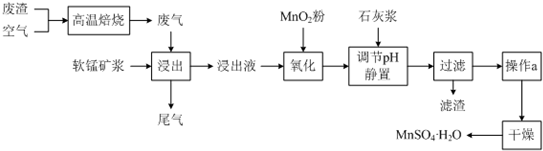
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7~8.3.
| A. | AgNO3、NaCl、Na2SO4、NaI | B. | Na2SO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、NaCl、NaNO3 | D. | NaCl、HCl、NaAlO2、NaHCO3 |
| A. | c(Na+)+c(H+)=c(A-)+c(OH-) | |
| B. | c(A-)+c(HA)=2c(Na+) | |
| C. | 若混合液呈酸性,则c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) | |
| D. | 若混合液呈碱性,则c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+) |
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3mol H2O | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 乙醇的核磁共振氢谱中有三个峰,峰面积之比是l:2:3 |