题目内容
1.硫酸铜在农业生产和生活中都有重要的应用,请回答下列问题:(1)铜与浓硫酸共热是制备硫酸铜的方法之一,写出反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O. 但该反应生成的气体污染环境.为避免环境污染,可在铜粉与稀硫酸的混合物中通入热空气,反应的总化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.
(2)将铜粉置于稀硫酸中不发生反应,加入双氧水,则铜粉可逐渐溶解.写出反应的离子方程式:Cu+H2O2+2H+=Cu2++2H2O
(3)将适量稀硫酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶可得到硫酸铜晶体,为了节约原料,H2SO4和HNO3的物质的量之比最佳为3:2.
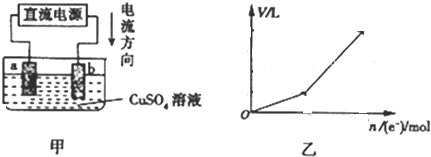
(4)用惰性电极电解硫酸铜溶液,实验装置如图甲所示.图乙是电解过程产生气体的总体积V与转移电子的物质的量n(e-)的关系图.电解过程中,a电极的现象是先有红色物质析出,后有气泡产生;b电极的电极反应式为4OH--4e-═H2O+O2↑.
分析 (1)铜与浓硫酸共热生成硫酸铜、二氧化硫和水;铜粉与稀硫酸的混合物中通入热空气,反应生成硫酸铜和水;
(2)酸性环境下双氧水具有氧化性,能将金属铜氧化;
(3)依据铜和稀硝酸反应的离子方程式,理解反应实质氢离子是硫酸和硝酸提供;
(4)由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,结合图2可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,据此分析.
解答 解:(1)铜与浓硫酸共热的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,铜粉与稀硫酸的混合物中通入热空气,反应生成硫酸铜和水,方程式为:
2Cu+O2+2H2SO4=2CuSO4+2H2O,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2Cu+O2+2H2SO4=2CuSO4+2H2O;
(2)金属铜在酸性环境下和双氧水的反应为:Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(3)验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,依据离子反应实质,氢离子是硝酸和硫酸共同提供,氢离子分析可知最佳比为6:2,所以硫酸和硝酸物质的量之比最佳为3:2;故答案为:3:2;
(4)由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,结合图2可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,所以a为阴极,先发生Cu2++2e-═Cu,后发生2H++2e-═H2↑,a电极表面先有红色物质析出,后有气泡产生;b为阳极,溶液中的氢氧根离子放电,则b电极上发生的反应方程式为:4OH--4e-═H2O+O2↑,
故答案为:先有红色物质析出,后有气泡产生;4OH--4e-═H2O+O2↑.
点评 本题考查了硫酸铜的制备,电解过程的分析,侧重方程式的书写,题目综合性强,需要扎实的基础知识,题目难度中等.

| A. | C气体的体积分数增大 | B. | 平衡向逆反方向移动 | ||
| C. | 气体A的转化率升高 | D. | m+n>p |
| A. | 14g聚乙烯中所含原子数为3NA | |
| B. | 48g 甲硫醇(CH4S)中含有C-H键数目为4NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 0.1mol苯乙烯中含有双键的数目为0.4NA |
过程Ⅰ:
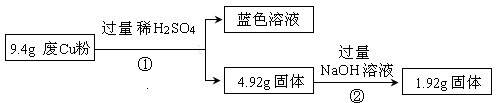
(1)废Cu粉中一定含有的杂质是Fe2O3、SiO2(填化学式)
(2)写出过程②发生反应的离子方程式:SiO2+2OH-═SiO32-+H2O.
过程Ⅱ:
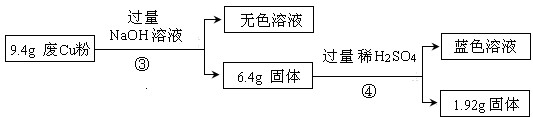
(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是m(Fe2O3):m(Cu):m(SiO2)=16:16:15(化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
(5)下列与Ⅲ方案 相关的叙述中,正确的是ACD填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在.
| A. | 氯化氢 | B. | 乙醇 | C. | 碘 | D. | 氢氧化钠 |
| A. | c(Na+)+c(H+)=c(A-)+c(OH-) | |
| B. | c(A-)+c(HA)=2c(Na+) | |
| C. | 若混合液呈酸性,则c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) | |
| D. | 若混合液呈碱性,则c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+) |
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.