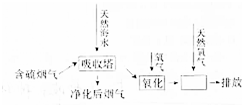
题目内容
17.在某温度下,将1mol A和2mol B充入一密闭容器中,发生反应:aA(g)+B(g)?C(g)+D(g),一段时间后达平衡,已知各物质的平衡浓度的关系为ca(A)•c(B)=c(C)•c(D).若温度不变,将容器的体积缩小为原来的$\frac{1}{2}$,A 的转化率没有发生变化,则B的转化率为( )| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
分析 平衡时各物质的平衡浓度的关系为ca(A)•c(B)=c(C)•c(D),则平衡常数K=1,若温度不变,将容器的体积缩小为原来的$\frac{1}{2}$,A 的转化率没有发生变化,说明增大压强平衡不移动,则a+1=1+1,故a=1,设转化的B的物质的量为xmol,表示出平衡时各组分物质的量,结合平衡常数列方程计算解答.
解答 解:平衡时各物质的平衡浓度的关系为ca(A)•c(B)=c(C)•c(D),则平衡常数K=1,若温度不变,将容器的体积缩小为原来的$\frac{1}{2}$,A 的转化率没有发生变化,说明增大压强平衡不移动,则a+1=1+1,故a=1,
设转化的B的物质的量为xmol,则:
A(g)+B(g)?C(g)+D(g)
起始量(mol):1 2 0 0
转化量(mol):x x x x
平衡量(mol):1-x 2-x x x
反应前后气体的物质的量不变,可以用物质的量代替浓度计算平衡常数,故$\frac{x×x}{(1-x)×(2-x)}$=1,解得x=$\frac{2}{3}$,故B的转化率为$\frac{\frac{2}{3}mol}{2mol}$×100%=33.3%,
故选:C.
点评 本题考查化学平衡计算,涉及平衡常数计算及应用,关键是判断a的值,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
12.下列说法正确的是( )
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | |
| D. | 常温下将Al片放入浓硝酸中,无明显变化,所以Al与浓硝酸不反应 |
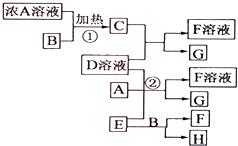 以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H. ;
;