题目内容
6.现有铁、铝、硅的混合物,将其分成两等份,一份加足量盐酸,一份加足量NaOH溶液,结果产生氢气的量相同,求混合物中铁和硅的物质的量比(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)分析 根据题目信息可知,铁和铝与稀盐酸生成氢气,铝和硅与氢氧化钠生成氢气;铝和盐酸、氢氧化钠溶液反应的方程式为:2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,说明相同质量的铝与盐酸或者氢氧化钠生成氢气的质量相等;则铁和盐酸生成的氢气的量等于硅和氢氧化钠生成的氢气的量,据此列式进行计算.
解答 解:根据题目信息可知,铁和铝与稀盐酸生成氢气,铝和硅与氢氧化钠生成氢气.铝和盐酸、NaOH溶液反应的反应方程式为:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,说明相同质量的铝与盐酸或者氢氧化钠生成氢气的质量相等,
则铁和盐酸生成的氢气与硅和氢氧化钠生成的氢气相等,
设铁与盐酸生成的氢气的物质的量为n,硅的物质的量为x,铁的物质的量为y,
Si+2NaOH+H2O═Na2SiO3+2H2↑
1 2
x n
则:n=2x,
Fe+2HCl=FeCl2+H2↑,
1 1
y n
则:y=n,
生成的氢气相等,则:n=2x=y,
整理可得:x:y=1:2,
答:混合物中铁和硅的物质的量比1:2.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意等量的铝与盐酸、氢氧化钠溶液反应时生成的氢气的量相等,试题培养了学生的化学计算能力.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
16.下列有关盐类水解的叙述中正确的是( )
| A. | 溶液呈中性的盐一定是强酸、强碱生成的盐 | |
| B. | 含有弱酸根盐的水溶液一定呈碱性 | |
| C. | 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 | |
| D. | 强酸强碱盐的水溶液一定呈中性 |
17.在某温度下,将1mol A和2mol B充入一密闭容器中,发生反应:aA(g)+B(g)?C(g)+D(g),一段时间后达平衡,已知各物质的平衡浓度的关系为ca(A)•c(B)=c(C)•c(D).若温度不变,将容器的体积缩小为原来的$\frac{1}{2}$,A 的转化率没有发生变化,则B的转化率为( )
| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
14.精炼铜的过程中,电解质溶液中的[Fe2+]、[Zn2+]会逐渐增大而影响进一步电解. 甲同学设计下图除杂方案:
已知:
请回答下列问题:
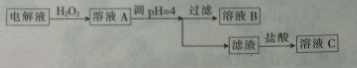
(1)加入H2O2目的是将Fe2+氧化为Fe3+.
(2)乙同学认为应将方案中的pH调节至8,你认为此观点不正确(填“正确”或“不正确”)理由是同时会使Cu2+生成沉淀而除去.
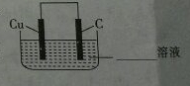
(3)利用铜棒、石墨棒和溶液C(填“B”或“C”)可设计一个原电池.该原电池的正极反应式为Fe3++e-=Fe2+.请在下图中完成该原电池的设计(标出电解质溶液和电子流动方向).
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |

(1)加入H2O2目的是将Fe2+氧化为Fe3+.
(2)乙同学认为应将方案中的pH调节至8,你认为此观点不正确(填“正确”或“不正确”)理由是同时会使Cu2+生成沉淀而除去.
(3)利用铜棒、石墨棒和溶液C(填“B”或“C”)可设计一个原电池.该原电池的正极反应式为Fe3++e-=Fe2+.请在下图中完成该原电池的设计(标出电解质溶液和电子流动方向).

1.在氢气还原氧化铜的实验中( )
| A. | 氧化铜发生还原反应 | B. | 氢气发生还原反应 | ||
| C. | 铜发生还原反应 | D. | 水发生还原反应 |
11.取两份等质量的铝份和铁粉,分别与足量的盐酸反应,在相同状态下产生的气体体积之比是( )
| A. | 1:1 | B. | 3:2 | C. | 28:9 | D. | 2:3 |
18.钠和水反应
| 实验现象 | 结论或解释 |
| 1.钠浮在水面上 | 钠的密度比水小 |
| 2.钠熔成小球 | 钠的熔点低,反应剧烈 |
15.下列说法中错误的是( )
| A. | 电解质溶液导电的原因是靠自由移动的阴、阳离子 | |
| B. | 电解质在水溶液中不一定完全电离 | |
| C. | 纯净的电解质在液态时,有的导电,有的不导电 | |
| D. | 无水CuSO4不导电,但胆矾中含结晶水,所以胆矾可以导电 |
 HCN+OH-
HCN+OH-