题目内容
9.二氧化碳是污染大气的主要有害物质之一,有是形成酸雨的罪魁祸首之一,从一定的程度上讲,可以说与我们的生产生活有着广泛的联系.(1)目前,食品行业大都采用二氧化碳漂白食品,为测定食品中残留二氧化碳的含量,通常采用的实验方法主要是:样品经处理后,加入氢氧化钠使残留的二氧化碳以亚硫酸盐的形式固定,在加入硫酸使二氧化硫游离,在加入碘标准溶液反应掉二氧化碳.
①写出SO2与NaOH反应的离子方程式SO2+2OH-═SO32-+H2O.
②碘与SO2反应时,为使现象明显可通常在碘水中加入淀粉指示剂.
(2)火力发电是重要的电力来源,但是煤燃烧排放的SO2会造成一系列环境问题.有关资料提示利用海水除硫是一种有效的方法,其工艺流程如图所示:

已知海水中主要含有Na+、K+、Ca+、Mg2+、Cl-、Br-等离子,天然海水的pH≈8,呈弱碱性.
①吸收塔内利用天然海水吸收含硫烟气,是利用了二氧化硫的哪些性质AC
A.酸性氧化物 B.还原性 C.易溶于水 D.漂白性 E.氧化性
②天然海水吸收含硫烟气体后,用氧气进行氧化处理,其反应的离子方程式为2SO32-+O2═2SO42-或2HSO3-+O2═2SO42-+2H+;
③氧化后的海水需要用大量的天然海水与之混合后才能释放,该操作的主要目的是中和、稀释氧气氧化的海水中生成的酸.
(3)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤.已知某温度下,向体积为10 L的密闭容器中加入4.0 mol SO2和10.0 mol O2,当反应达到平衡时,测得混合气体的物质的量为13.0 mol,则SO2的转化率为50%.
分析 (1)①二氧化硫是酸性氧化物与NaOH反应生成了亚硫酸根和水;
②可在碘水中加入淀粉,当与二氧化硫加好反应时,溶液蓝色恰好褪去;
(2)①二氧化硫易溶于水,且与水反应生成亚硫酸被海水中氢氧根中和为亚硫酸根和亚硫酸氢根;
②当用氧气进行氧化反应时主要氧化还原性较强的亚硫酸根和亚硫酸氢根;
③氧气氧化后的海水因生产酸,使溶液呈酸性,而天然海水呈弱碱性;
(3)气体中物质的量减少等于反应的氧气的物质的量.
解答 解:(1)①二氧化硫是酸性氧化物与NaOH反应生成了亚硫酸根和水,反应的离子方程式为:SO2+2OH-═SO32-+H2O,故答案为:SO2+2OH-═SO32-+H2O;
②可在碘水中加入淀粉,当与二氧化硫加好反应时,溶液蓝色恰好褪去,这样可使现象明显,故答案为:淀粉;
(2)①二氧化硫易溶于水,且与水反应生成亚硫酸被海水中氢氧根中和为亚硫酸根和亚硫酸氢根,因利用天然海水吸收二氧化硫主要利用了二氧化硫易溶于水及酸性氧化物的性质,故答案为:AC;
②当用氧气进行氧化反应时主要氧化还原性较强的亚硫酸根和亚硫酸氢根,离子反应为2SO32-+O2═2SO42-或2HSO3-+O2═2SO42-+2H+,故答案为:2SO32-+O2═2SO42-或2HSO3-+O2═2SO42-+2H+;
③用氧气氧化后的海水因生产酸,使溶液呈酸性,而天然海水呈弱碱性,故将二者按适当比例混合后可达到排放的要求,故答案为:中和、稀释氧气氧化的海水中生成的酸;
(3)2SO2+O2?2SO3 △n=1
2 1 2
n(初)4.0 10.0 0
△n 2.0 1.0 2.0 14.0-13.0=1.0
n(平)2.0 9.0 2.0
则二氧化硫的转化率为$\frac{2.0mol}{4.0mol}$×100%=50%,故答案为:50%.
点评 本题考查了工业制硫酸的流程和生产装置的应用及尾气处理的方法,涉及酸碱中和反应、氧化还原反应及盐类水解等,综合性较强,侧重分析能力、知识迁移应用能力的考查,题目难度中等.

 优学名师名题系列答案
优学名师名题系列答案①同质量不同密度的CO和N2
②同温同体积的H2和Cl2
③同体积同密度的O2和O3
④同压同体积的N2O和CO2.
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
| A. | 除去CO2中少量O2:用点燃的方法 | |
| B. | 除去NaCl溶液中的Na2SO4:加入适量Ba(NO3)2溶液后,过滤 | |
| C. | 除去Cu中的少量Fe:加入足量稀硫酸溶液后,过滤,洗涤,干燥 | |
| D. | 除去CO2中的少量HCl:通入NaOH溶液后,收集气体 |
| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
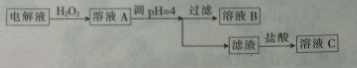
(1)加入H2O2目的是将Fe2+氧化为Fe3+.
(2)乙同学认为应将方案中的pH调节至8,你认为此观点不正确(填“正确”或“不正确”)理由是同时会使Cu2+生成沉淀而除去.
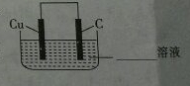
(3)利用铜棒、石墨棒和溶液C(填“B”或“C”)可设计一个原电池.该原电池的正极反应式为Fe3++e-=Fe2+.请在下图中完成该原电池的设计(标出电解质溶液和电子流动方向).
| A. | 氧化铜发生还原反应 | B. | 氢气发生还原反应 | ||
| C. | 铜发生还原反应 | D. | 水发生还原反应 |
| 实验现象 | 结论或解释 |
| 1.钠浮在水面上 | 钠的密度比水小 |
| 2.钠熔成小球 | 钠的熔点低,反应剧烈 |

