题目内容
2.FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.I.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
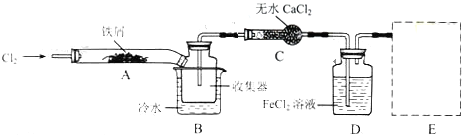
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;加热\;}}{\;}$2FeCl3.
(2)实验操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②④.
(3)装置B中的冷水作用为B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管;装置D中FeCl2全部反应后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:酸性KMnO4溶液.(选填“KSCN溶液”“酸性KMnO4溶液”或“AgNO3溶液”)
(4)在虚线框内画出尾气吸收装置E并注明试剂
II.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
FeCl3与H2S反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+
电解池中H+在阴极放电产生H2的体积为8.96L(标况),电解池中通过的电子数为0.8mol
综合分析实验 II的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;
②FeCl3可以循环利用.
分析 本题是探究模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S的综合题型,涉及制备氯化铁时根据其易水解和受热易升华的特性,要保持无氧干燥的反应环境,并利用加热的方式防氯化铁遇冷凝华,还考查了利用Fe2+的还原性用高锰酸钾溶液检验其存在于溶液中,另外还利用氯化铁的氧化性吸收硫化氢有毒气体,利用电解反应后的溶液重新生成得到氯化铁溶液循环利用,提高原料的利用率,据此可作答.
(1)装置A中铁与氯气反应生成氯化铁;
(2)防止FeCl3潮解,不与水蒸气接触;
(3)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管;检验FeCl2是否失效应检验FeCl2是否存在,可以用KMnO4溶液检验;
(4)为防止氯气的尾气污染环境,可用氢氧化钠溶液吸收,不用考虑防倒吸;
Ⅱ三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应,化学方程式为2FeCl3+H2S═2FeCl2+S↓+2HCl,再改写为离子反应方程式;
电解氯化亚铁时,阴极阳离子得到电子发生还原反应生成H2,每生成一个氢分子转移2个电子,可结合氢气的物质的量计算转移电子数目,结合绿色化学的理论并根据FeCl3可以循环利用解答.
解答 解:(1)装置A中铁与氯气反应生成氯化铁,反应为2Fe+3Cl2$\frac{\underline{\;加热\;}}{\;}$2FeCl3,故答案为:2Fe+3Cl2$\frac{\underline{\;加热\;}}{\;}$2FeCl3;
(2)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2,④用干燥的N2赶尽Cl2,故答案为:②④;
(3)B 中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管,酸性高锰酸钾溶液,装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,(注意“全部”字眼)检验FeCl2是否失效就是检验二价铁离子,试样中同时含有三价铁,应利用二价铁的还原性,选择酸性高锰酸钾溶液,
故答案为:B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;干燥管;酸性高锰酸钾溶液;
(4)用氢氧化钠溶液吸收含氯气的尾气,不需要考虑防倒吸,可用此装置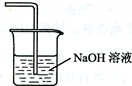 ,故答案为:
,故答案为: ;
;
Ⅱ发生反应为2FeCl3+H2S=2FeCl2+2HCl+S↓,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,阴极发生氢离子得电子的还原反应,2H++2e-═H 2↑,H2的体积为8.96L(标况)物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,转移电子的物质的是为0.4mol×2=0.8mol,
电解池中最终得到的FeCl3可重新用来吸收H2S,得到循环利用,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;0.8mol;FeCl3可以循环利用.
点评 本题是一道综合题,难度中等,考查了学生运用知识解决问题的能力,涉及到的知识点较多,掌握基础是关键.

 阅读快车系列答案
阅读快车系列答案| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
| 实验现象 | 结论或解释 |
| 1.钠浮在水面上 | 钠的密度比水小 |
| 2.钠熔成小球 | 钠的熔点低,反应剧烈 |
| A. | 电解质溶液导电的原因是靠自由移动的阴、阳离子 | |
| B. | 电解质在水溶液中不一定完全电离 | |
| C. | 纯净的电解质在液态时,有的导电,有的不导电 | |
| D. | 无水CuSO4不导电,但胆矾中含结晶水,所以胆矾可以导电 |
| A. | 常用作净水剂的KAl(SO4)2和漂白粉都是强电解质 | |
| B. | 氯气溶于水生成的次氯酸具有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| C. | 氮氧化物可以破坏臭氧层,也能形成酸雨 | |
| D. | “玉兔”月球车太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅 |
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
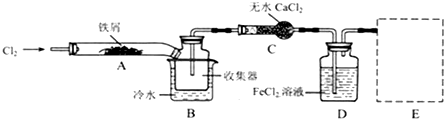
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤.
(3)如果没有装置C的设计,会导致D装置中水挥发到接受器,使FeCl3潮解.
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用:
 、Cl2+2OH-=Cl-+ClO-+H2O.
、Cl2+2OH-=Cl-+ClO-+H2O.(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式:2Fe3++2H2S=2Fe2++2H++S↓.
Ⅱ.反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③既有Fe3+又有Fe2+.
为探究溶液的组成,实验如下:
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液. | 溶液中出现红色. | 说明:假设②不成立,假设①或③成立; 反应的离子方程式是Fe3++3SCN-=Fe(SCN)3. |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液. | 溶液紫红色退去 | 说明:假设②或③成立. |
 HCN+OH-
HCN+OH-