题目内容
13.高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO.下列选项中,一定符合反应达到化学平衡时情况的选项是( )| A. | 压缩体积达到新平衡时,CO的浓度增大的倍数比CO2的浓度增大的倍数更大 | |
| B. | 速率关系:2v(CO2)=v(CO) | |
| C. | 转移电子数随温度升高而增多 | |
| D. | 气体密度随着焦炭的增加而增大 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、对于反应C+CO2(g)=2CO(g)△H>0,压缩体积,平衡逆向移动,CO的浓度增大的倍数比CO2的浓度增大的倍数小,故A错误;
B、化学平衡时速率之比等于物质的量之比,不管反应是否达到平衡,均有2v正(CO2)=v正(CO),2v逆(CO2)=v逆(CO),因此速率关系符合2v(CO2)=v(CO),若反应达到平衡,则v正(CO)=v逆(CO),v正(CO2)=2v逆(CO2),则根据2v正(CO2)=v正(CO),2v逆(CO2)=v逆(CO)得,平衡时有2v正(CO2)=v逆(CO),
2v逆(CO2)=v正(CO),因此可以判断平衡时速率关系符合2v(CO2)=v(CO),故B正确;
C、温度升高平衡正向移动,消耗焦炭的量增加,所以转移电子数增多,达到平衡时转移电子数不再变化,故C正确;
D、焦炭的是增加,平衡不移动,气体的物质的量不变,体积固定,所以密度是个定值,故D错误;
故选BC.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
3.工业上常用稀硫酸清洗铁表面的锈层,这是利用硫酸的( )
| A. | 强氧化性 | B. | 不挥发性 | C. | 吸水性 | D. | 酸性 |
4.某有机物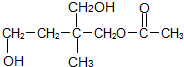 经下列反应后,该物质一定不含有手性碳原子的是( )
经下列反应后,该物质一定不含有手性碳原子的是( )
 经下列反应后,该物质一定不含有手性碳原子的是( )
经下列反应后,该物质一定不含有手性碳原子的是( )| A. | 酯化 | B. | 水解 | C. | 催化氧化 | D. | 消去 |
1.如图为Zn、铜水果电池装置示意图,下列说法正确的是( )
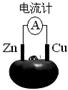

| A. | 铜片为负极,发生还原反应 | B. | 锌片上发生还原反应:Zn-2e-=Zn2+ | ||
| C. | 该装置将电能转变为化学能 | D. | 电子由锌片沿导线流向铜极 |
8.一定量CH4不完全燃烧得到49.6g CO2、CO和水蒸气的混合气体,让其通过浓H2SO4时浓硫酸增重25.2g,则混合气体中CO2的质量为( )
| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
18.下列有关晶胞的叙述正确的是( )
| A. | 晶胞是晶体中最小的结构基本单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都完全属于该晶胞 | |
| D. | 晶胞都是正方体 |
5.下列实验设计正确且能达到目的是( )
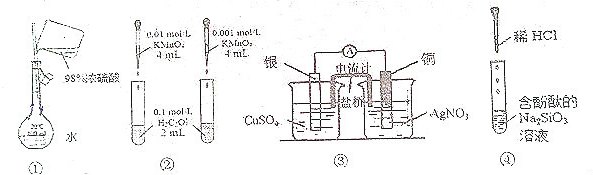

| A. | 装置①配制一定的物质的量浓度的稀硫酸溶液 | |
| B. | 装置②根据溶液褪色的快慢比较浓度对反应速率的影响 | |
| C. | 装置③制作原电池 | |
| D. | 装置④制备硅胶 |
9.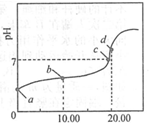 常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
 常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )| A. | a点PH=2 | |
| B. | b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) | |
| C. | c点表示NaOH溶液与CH3COOH溶液恰好完全反应 | |
| D. | d点对用的溶液中,水的电离程度小于同温下纯水的电离程度 |
10. 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:(1)配制100ml 0.10mol•L-1NaOH标准溶液,计算需称量0.4g氢氧化钠固体.
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:DF.
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.