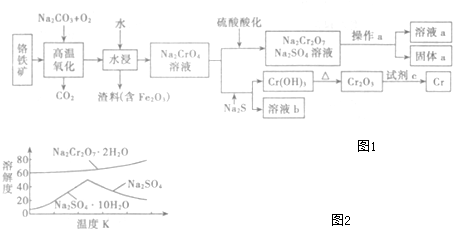
题目内容
5.下列实验设计正确且能达到目的是( )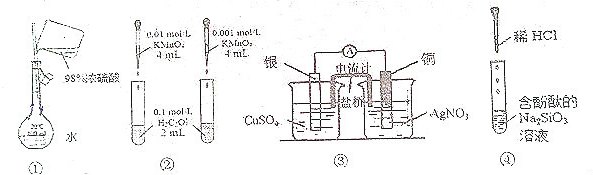
| A. | 装置①配制一定的物质的量浓度的稀硫酸溶液 | |
| B. | 装置②根据溶液褪色的快慢比较浓度对反应速率的影响 | |
| C. | 装置③制作原电池 | |
| D. | 装置④制备硅胶 |
分析 A.不能将浓硫酸直接注入容量瓶中;
B.只有浓度一个变量;
C.右侧烧杯中Cu与硝酸银反应,不能构成原电池;
D.滴加盐酸,溶液由红色变为无色,可得到胶体.
解答 解:A.不能将浓硫酸直接注入容量瓶中,应在烧杯中稀释、冷却后转移到容量瓶中,故A错误;
B.只有浓度一个变量,则根据溶液褪色的快慢比较浓度对反应速率的影响,故B正确;
C.右侧烧杯中Cu与硝酸银反应,不能构成原电池,应将两个烧杯中电解质互换,故C错误;
D.滴加盐酸,溶液由红色变为无色,可得到胶体,则图中装置可制备硅胶,故D正确;
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液配制、反应速率的影响因素、原电池、胶体制备等,把握物质的性质、实验操作、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列化合物,既能发生消去反应,又能发生催化氧化反应的是( )
| A. | CH3OH | B. | C2H5OH | C. | 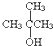 | D. | 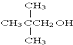 |
16.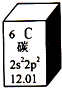 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的原子序数为6 | |
| B. | 该元素所有原子的质子数均为6 | |
| C. | 该元素的相对原子质量为12.01 | |
| D. | 该元素没有同位素,所有原子的中子数均为6 |
13.高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO.下列选项中,一定符合反应达到化学平衡时情况的选项是( )
| A. | 压缩体积达到新平衡时,CO的浓度增大的倍数比CO2的浓度增大的倍数更大 | |
| B. | 速率关系:2v(CO2)=v(CO) | |
| C. | 转移电子数随温度升高而增多 | |
| D. | 气体密度随着焦炭的增加而增大 |
20.某混合溶液中可能含有下列离子中的若干种:${NH}_{4}^{+}$、Al3+、Fe2+、Fe3+、${SO}_{4}^{2-}$、${NO}_{2}^{-}$、${NO}_{3}^{-}$、${CO}_{3}^{2-}$,现取三份20mL该溶液于锥形瓶,分别进行如下实验:
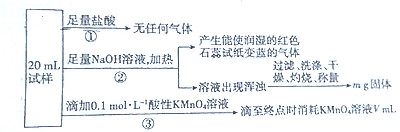
根据上述实验,以下说法不正确的是( )

根据上述实验,以下说法不正确的是( )
| A. | 由实验①可推断原混合溶液中一定不存在${NO}_{2}^{-}$、${CO}_{3}^{2-}$ | |
| B. | 由实验①③可推断原混合溶液中一定存在Fe2+,一定不存在${NO}_{3}^{-}$ | |
| C. | 原混合溶液中肯定存在${NH}_{4}^{+}$、Fe2+、${SO}_{4}^{2-}$ | |
| D. | 如果给出m、V的具体数据,可以确定Al3+、Fe3+是否存在 |
10.下列物质中,不属于醇类的是( )
| A. | C4H9OH | B. | C6H5CH2OH | C. | C6H5OH | D. | 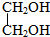 |
1.下列过程中化学键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤MgCl2溶解于水 ⑥NaCl熔化.
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤MgCl2溶解于水 ⑥NaCl熔化.
| A. | 全部 | B. | ②③④⑤⑥ | C. | ④⑤⑥ | D. | ⑤⑥ |
2.下列关于元素周期律和元素周期表的说法中正确的是( )
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 目前已知发现的第ⅥA族元素为5种,所以该族元素共有5种单质 |