题目内容
8.一定量CH4不完全燃烧得到49.6g CO2、CO和水蒸气的混合气体,让其通过浓H2SO4时浓硫酸增重25.2g,则混合气体中CO2的质量为( )| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过浓硫酸,浓硫酸的作用是吸收水分,浓硫酸增重25.2g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量.
解答 解:产物通过浓硫酸时,浓硫酸增重25.2g为水的质量,
所以n(H2O)=$\frac{25.2g}{18g/mol}$=1.4mol,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×1.4mol=0.7mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,
所以m(CO)+m(CO2)=49.6g-25.2g=24.4g,
所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,
解之:n(CO2)=0.3mol,
所以生成二氧化碳的质量为0.3mol×44g/mol=13.2g.
故选:B.
点评 本题考查混合物的计算,难度中的,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列物质性质的变化规律与分子间作用力有关的是( )
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的沸点依次升高 |
16.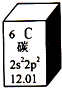 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的原子序数为6 | |
| B. | 该元素所有原子的质子数均为6 | |
| C. | 该元素的相对原子质量为12.01 | |
| D. | 该元素没有同位素,所有原子的中子数均为6 |
3.下列有关电化学原理的说法中,错误的是( )
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 | |
| C. | 氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
13.高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO.下列选项中,一定符合反应达到化学平衡时情况的选项是( )
| A. | 压缩体积达到新平衡时,CO的浓度增大的倍数比CO2的浓度增大的倍数更大 | |
| B. | 速率关系:2v(CO2)=v(CO) | |
| C. | 转移电子数随温度升高而增多 | |
| D. | 气体密度随着焦炭的增加而增大 |
20.某混合溶液中可能含有下列离子中的若干种:${NH}_{4}^{+}$、Al3+、Fe2+、Fe3+、${SO}_{4}^{2-}$、${NO}_{2}^{-}$、${NO}_{3}^{-}$、${CO}_{3}^{2-}$,现取三份20mL该溶液于锥形瓶,分别进行如下实验:
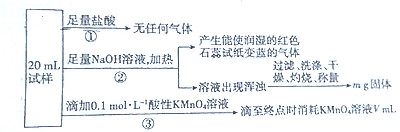
根据上述实验,以下说法不正确的是( )

根据上述实验,以下说法不正确的是( )
| A. | 由实验①可推断原混合溶液中一定不存在${NO}_{2}^{-}$、${CO}_{3}^{2-}$ | |
| B. | 由实验①③可推断原混合溶液中一定存在Fe2+,一定不存在${NO}_{3}^{-}$ | |
| C. | 原混合溶液中肯定存在${NH}_{4}^{+}$、Fe2+、${SO}_{4}^{2-}$ | |
| D. | 如果给出m、V的具体数据,可以确定Al3+、Fe3+是否存在 |
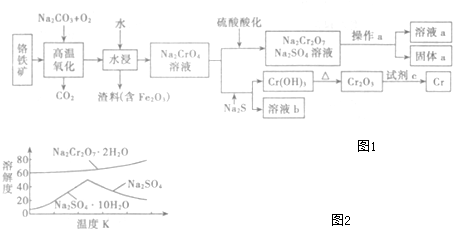
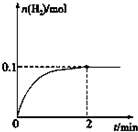 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应: