题目内容
3.工业上常用稀硫酸清洗铁表面的锈层,这是利用硫酸的( )| A. | 强氧化性 | B. | 不挥发性 | C. | 吸水性 | D. | 酸性 |
分析 铁锈的主要成分为铁的氧化物,能够与酸反应生成可溶性的铁盐和水,据此解答.
解答 解:铁制品表面的锈层主要成分为铁的氧化物,金属氧化物和硫酸反应生成硫酸铁和水,工业上常用稀硫酸清洗铁表面的锈层,这是利用硫酸的酸性,
故选D.
点评 本题考查浓硫酸的性质,明确浓硫酸具有吸水性、脱水性、强氧化性、酸性,注意吸水性和脱水性的区别,题目难度不大.

练习册系列答案
相关题目
13.正丁醛经催化加氢可制备1-丁醇.为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
| A. | 萃取、过滤、蒸馏、蒸馏 | B. | 过滤、分液、蒸馏、萃取 | ||
| C. | 过滤、蒸馏、过滤、蒸馏 | D. | 过滤、分液、过滤、蒸馏 |
14.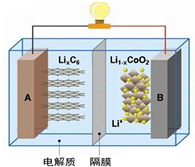 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+从右边流向左边 | |
| B. | 放电时,正极锂的化合价未发生改变 | |
| C. | 充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
11.共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2;②SiO2;③石墨;④金刚石;⑤CaH2;⑥白磷(P4),其中含有两种结合力的组合是( )
| A. | ①③⑤⑥ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
8.下列化学用语书写不正确的是( )
| A. | 酯基的官能团符号:-COO- | B. | 硝基苯的结构简式: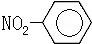 | ||
| C. | COCl2分子的结构式: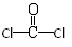 | D. | 乙炔的电子式: |
15.下列化合物,既能发生消去反应,又能发生催化氧化反应的是( )
| A. | CH3OH | B. | C2H5OH | C. | 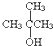 | D. | 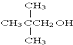 |
12.现有CH3COOH和两种链状单烯烃的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
| A. | $\frac{1-a}{7}$ | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$(1-a) | D. | $\frac{12}{13}$(1-a) |
13.高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO.下列选项中,一定符合反应达到化学平衡时情况的选项是( )
| A. | 压缩体积达到新平衡时,CO的浓度增大的倍数比CO2的浓度增大的倍数更大 | |
| B. | 速率关系:2v(CO2)=v(CO) | |
| C. | 转移电子数随温度升高而增多 | |
| D. | 气体密度随着焦炭的增加而增大 |