题目内容
1.某学习小组需0.10mol/L的Na2CO3溶液450mL.下列有关说法正确的是( )| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
分析 需0.10mol/L的Na2CO3溶液450mL,实验室没有450mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM=0.10mol/L×0.5L×106g/mol=5.3g,碳酸根离子为弱酸根离子水解生成碳酸氢根离子和氢氧根离子,据此解答.
解答 解:需0.10mol/L的Na2CO3溶液450mL,实验室没有450mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM=0.10mol/L×0.5L×106g/mol=5.3g,碳酸根离子为弱酸根离子水解生成碳酸氢根离子和氢氧根离子,
A.称量前应将Na2CO3•xH2O灼烧至恒重,否则称取的碳酸钠质量不准确,溶液浓度不准确,故A正确;
B.配制时需用托盘天平称取5.3g无水碳酸钠,故B错误;
C.碳酸根离子为弱酸根离子,部分水解生成碳酸氢根离子和氢氧根离子,所以100 mL上述溶液含离子总数大于0.03NA,故C错误;
D.碳酸钠为强碱弱酸盐,水解显碱性,能够与玻璃中的二氧化硅反应生成粘性物质硅酸钠,所以不能用磨口玻璃塞盛放,故D错误;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理是解题关键,注意碳酸根离子的水解,注意碱性物质的保存方法,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | 100mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA | |||||||||||
| C. | 已知:
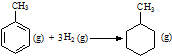 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
9.往含Fe3+、H+、NO3-的混合液中加入少量SO${\;}_{3}^{2-}$,充分反应后,下列表示该反应的离子方程式正确的是( )
| A. | 2Fe3++SO${\;}_{3}^{2-}$+H2O═2Fe2++SO${\;}_{4}^{2-}$+2H+ | |
| B. | 2H++SO${\;}_{3}^{2-}$═H2O+SO2↑ | |
| C. | 2H++2NO${\;}_{3}^{-}$+3SO${\;}_{3}^{2-}$═3SO${\;}_{4}^{2-}$+2NO↑+H2O | |
| D. | 2Fe3++3SO${\;}_{3}^{2-}$+3H2O═2Fe(OH)3↓+3SO2↑ |
6.下列叙述正确的是( )
| A. | 氯化铯晶体中,每1个Cs+与其它8个Cs+等距离紧邻 | |
| B. | 金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子 | |
| C. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
11.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | - | Cl- | |
| ② | KClO3 | 浓盐酸 | - | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中①组的反应可能有一种或两种元素被氧化 | |
| D. | 表中③组反应的离子方程式为:2MnO${\;}_{4}^{-}$+3H2O2+6H+═2Mn2++4O2↑+6H2O |
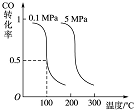 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇: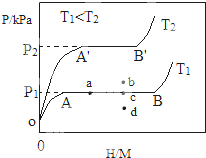 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.