题目内容
11.根据表中信息,判断下列叙述中正确的是( )| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | - | Cl- | |
| ② | KClO3 | 浓盐酸 | - | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中①组的反应可能有一种或两种元素被氧化 | |
| D. | 表中③组反应的离子方程式为:2MnO${\;}_{4}^{-}$+3H2O2+6H+═2Mn2++4O2↑+6H2O |
分析 A.氧化产物与还原产物均为Cl2;
B.氧化性:氧化剂大于氧化产物;
C.氯气可以氧化亚铁离子和溴离子;
D.电子不守恒.
解答 解:A.反应为KClO3+6HCl=KCl+3Cl2↑+3H2O,氧化产物与还原产物均为Cl2,电子转移数目是5e-,故A错误;
B.由①可知,亚铁离子先被氯气氧化,则氧化性为Cl2>Fe3+,故B错误;
C.氯气可以氧化亚铁离子和溴离子,当少量氯气反应时只氧化亚铁离子,当足量的氯气反应时氧化亚铁离子和溴离子,所以①组的反应可能有一种或两种元素被氧化,故C正确;
D.电子不守恒,正确的离子反应为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故D错误;
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意氧化性的比较及优先氧化的规律,题目难度中等.

练习册系列答案
相关题目
1.某学习小组需0.10mol/L的Na2CO3溶液450mL.下列有关说法正确的是( )
| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
2.下列说法正确的是( )
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | l mol金刚石中,含2 mol C-C键 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子化合物 |
19.下列物质中属于氧化物的是( )
| A. | H2O | B. | N2 | C. | O3 | D. | KMnO4 |
3.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 使酚酞变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | NaClO和NaCl混合溶液中:H+、NH4+、SO42-、Br- | |
| C. | 氯化亚铁溶液中:Na+、Ba2+、Br-、NO3- | |
| D. | 0.1 mol•L-1的NaAlO2 溶液:H+、Na+、Cl-、SO42- |
20. 2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )
2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )
 2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )
2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )| ① | ② | ③ | ④ | |
| A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
| B | Na2SO4 | K2SO4 | KCl | NH4Cl |
| C | NaCl | K2SO4 | KCl | NH4Cl |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
1.符合下列条件的溶液中,各组离子可能大量共存的是( )
| A. | pH=0的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 无色溶液中:Ba2+、Zn2+、Cl-、NO3- | |
| C. | 加入铝粉后能产生气体的溶液中:Mg2+、Ba2+、SO32-、NO3- | |
| D. | 常温下水电离出的c(H+)=10-12的溶液中:Fe3+、K+、ClO-、SO42- |
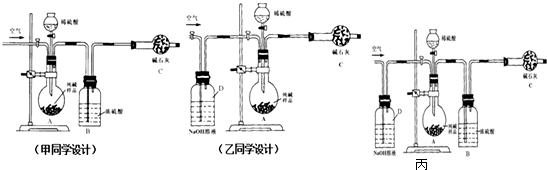
 ;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.