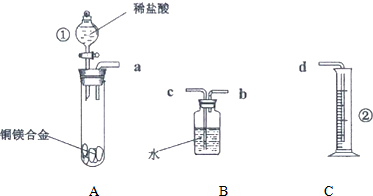
题目内容
11.现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO${\;}_{3}^{2-}$、X中的一种.(1)某同学通过分析,认为无需检验就可判断必有的两种物质是Na2CO3、Ba(OH)2
(2)为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕灰色沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解.则:
①X为B; A.SO32- B.SO42-C.CH3COO- D.SiO32-
②A中的化学键类型为离子键、共价键;
③将0.02mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为6.1g(精确到0.1g);
④利用上述已经确定的物质,可以检验出D、E中的阳离子.
请简述实验操作步骤、现象及结论取少量D的溶液与试管中,逐渐进入Ba(OH)2溶液至过量,先出现白色沉淀后溶解,则D中含有Al3+,若生成的白色沉淀不溶解,则E中含有Mg2+;
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则该反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
分析 (1)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,碳酸根离子只有和钠离子结合物质为可溶性物质,所以一定含有Na2CO3;因为它们所含阴阳离子互不相同,所以氢氧根离子只有和钡离子结合生成的物质具有可溶性,所以一定含有Ba(OH)2;
(2)①C与B的溶液混合时,产生红褐色沉淀和无色无味气体,沉淀为氢氧化铁、气体为二氧化碳;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则B为Na2CO3,A为Ba(OH)2,C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝;
②A为氢氧化钡,根据氢氧化钡的化学式判断含有的化学键类型;
③已知C为Fe2(SO4)3,A为Ba(OH)2,将0.02molA与0.01molC同时溶解在足量的蒸馏水中,反应生成碳酸钡沉淀和氢氧化铁沉淀,根据反应方程中的关系求出沉淀的量;
④D中含有NO3-,则E中含有Cl-,剩余Al3+、Mg2+,利用氢氧化铝溶液强碱的性质检验;
(3)酸性条件下,硝酸根离子和铜发生氧化还原反应而导致Cu溶解.
解答 解:(1)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,碳酸根离子只有和钠离子结合物质为可溶性物质,所以一定含有Na2CO3;因为它们所含阴阳离子互不相同,所以氢氧根离子只有和钡离子结合生成的物质具有可溶性,所以一定含有Ba(OH)2,所以无需检验就可判断必有的两种物质是Na2CO3、Ba(OH)2,
故答案为:Na2CO3;Ba(OH)2;
(2)①根据C与B的溶液混合时,产生红褐色沉淀和无色无味气体,可知沉淀为氢氧化铁、气体为二氧化碳,则B为Na2CO3,A为Ba(OH)2;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝,因C为Fe2(SO4)3,则阴离子有SO42-,则X为SO42-,
故选B;
②根据以上分析可知A为氢氧化钡,氢氧化钡中的氢氧根中含H-O共价键,钡离子与氢氧根离子之间形成了离子键,所以氢氧化钡中的化学键为离子键和共价键,
故答案为:离子键、共价键;
③已知C为Fe2(SO4)3,A为Ba(OH)2,将0.02molA与0.01molC同时溶解在足量的蒸馏水中,反应生成碳酸钡沉淀和氢氧化铁沉淀,Fe2(SO4)3+3Ba(OH)2═2Fe(OH)3↓+3BaSO4↓,根据方程式可知,硫酸铁过量,按照Ba(OH)2计算,
则n(BaSO4)=0.02mol,n(Fe(OH)3)=$\frac{2}{3}$×0.02mol,
所以沉淀的质量为m(BaSO4)+m(Fe(OH)3)=0.02mol×233g/mol+$\frac{2}{3}$×0.02mol×107g/mol=6.1g,
故答案为:6.1g;
④D中含有NO3-,则E中含有Cl-,剩余Al3+、Mg2+,Al(OH)3能溶于过量Ba(OH)2溶液,检验方案为:取少量D的溶液与试管中,逐渐进入Ba(OH)2溶液至过量,先出现白色沉淀后溶解,则D中含有Al3+,若生成的白色沉淀不溶解,则E中含有Mg2+,
故答案为:取少量D的溶液与试管中,逐渐进入Ba(OH)2溶液至过量,先出现白色沉淀后溶解,则D中含有Al3+,若生成的白色沉淀不溶解,则E中含有Mg2+;
(3)D为硝酸盐,加入稀硫酸后,相当于含有硝酸,硝酸和Cu发生氧化还原反应生成铜离子和NO,离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查物质检验实验方案设计,为高频考点,明确常见物质的性质、物质的溶解性、物质物质的量关系是解本题关键,注意离子检验方法及现象,易错点是(3)题,铜和稀硫酸不反应,但酸性条件下铜和硝酸根离子发生氧化还原反应,题目难度不大.

N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
其中甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器;实验测得起始、平衡时的有关数据如下表:
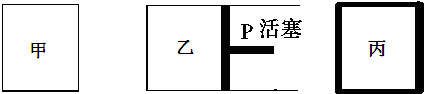
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:丙是甲的二倍 | |
| B. | 三个容器内反应的平衡常数:甲=乙>丙 | |
| C. | 达平衡时氨气的体积分数:甲>乙>丙 | |
| D. | 放出热量关系:b<a<92.4 |
| A. | CH≡C-CH3 | B. | 对二甲苯 | C. | 对甲乙苯 | D. | 邻甲乙苯 |
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②用过量的氨水除去Fe3+溶液中的少量Al3+
③Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2
④铝粉与氧化镁共热可制取金属镁
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
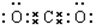
 .
.