题目内容
10. 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
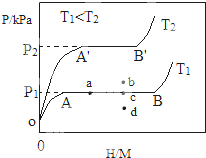
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比($\frac{H}{M}$).在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,$\frac{H}{M}$逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)?zMHy(s)△H1(I);在B点,氢化反应结束,进一步增大氢气压强,$\frac{H}{M}$几乎不变.
反应(I)的焓变△HⅠ<0(填“>”“<”或“=”).
反应(I)中z=$\frac{2}{y-x}$(用含x和y的代数式表示).
温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=30mL•g?1•min?1.
(2)当反应(I)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(I)可能处于图中的c点(填“b”“c”或“d”),该贮氢合金可通过加热或减压的方式释放氢气.η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)>η(T2)(填“>”“<”或“=”).
分析 (1)温度越高,压强越大,氢气的物质的量越大;zMHx(s)+H2(g)?zMHy(s)中遵循质量守恒定律,则反应前后H原子个数相同;吸氢速率v=$\frac{\frac{240mL}{2g}}{4min}$;由图可知,相同氢原子与金属原子的个数比时,T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动;
(2)当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,因温度不变,K不变,则平衡时氢原子与金属原子的个数比增大,平衡点在曲线AB上;释放氢气即为平衡逆向移动,结合该反应为放热反应、气体体积减小的反应特点解答;T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动,则该反应为放热反应,低温下有利于吸收氢.
解答 解:(1)由图可知,相同氢原子与金属原子的个数比时,T2温度高,对应的平衡时氢气的压强大,说明升高温度反应向生成氢气的方向移动,即升高温度向逆方向移动,则逆方向为吸热反应,所以正方向为放热反应,即△H1<0;zMHx(s)+H2(g)?zMHy(s)中遵循质量守恒定律,则反应前后H原子个数相同,则zx+2=zy,解得z=$\frac{2}{y-x}$;吸氢速率v=$\frac{\frac{240mL}{2g}}{4min}$=30mL•g-1•min-1;
故答案为:<;$\frac{2}{y-x}$;30;
(2)当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,因温度不变,K不变,平衡时氢原子与金属原子的个数比增大,平衡点在曲线AB上,则达到平衡后反应(Ⅰ)可能处于图中的c点;释放氢气即为平衡逆向移动,因该反应为放热反应、气体体积减小的反应,则该贮氢合金可通过加热或减压的方式释放氢气;T2温度高,对应的平衡时氢气的压强大,则升高温度,平衡逆向移动,则该反应为放热反应,低温下有利于吸收氢,T1<T2时,则η(T1)>η(T2);
故答案为:c;加热;减压;>.
点评 本题考查较综合,涉及化学平衡、热化学反应式、反应热计算及图象分析,把握平衡移动的影响因素、图象中纵横坐标的含义为解答的关键,(2)为解答的难点,侧重分析与应用能力的综合考查,题目难度中等.

①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②用过量的氨水除去Fe3+溶液中的少量Al3+
③Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2
④铝粉与氧化镁共热可制取金属镁
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
| A. | 14.3g | B. | 21.2g | C. | 10.6g | D. | 12.9g |
①C与O2 ②Na与O2 ③Fe与Cl2
④AlCl3溶液与氨水 ⑤CO2与NaOH溶液 ⑥Cu与硝酸.
| A. | 除③外 | B. | 除④外 | C. | 除③④外 | D. | 除②⑥外 |
| A. | 0.1mo/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.3mol/L |
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | l mol金刚石中,含2 mol C-C键 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子化合物 |
| A. | H2O | B. | N2 | C. | O3 | D. | KMnO4 |
 2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )
2014年世界杯足球赛在巴西举行,2016年巴西又将举办31届奥运会.奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质,能满足如图中阴影部分关系的是( )| ① | ② | ③ | ④ | |
| A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
| B | Na2SO4 | K2SO4 | KCl | NH4Cl |
| C | NaCl | K2SO4 | KCl | NH4Cl |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |