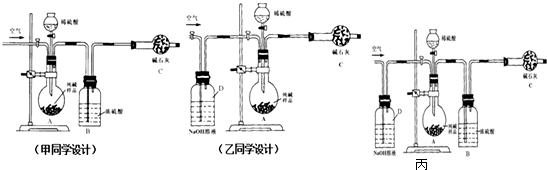
题目内容
16.铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法.实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换.交换完成后,流出溶液的OH-用0.40mol•L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL.计算该样品中氯的物质的量,并求出FeClx中x的值:3(列出计算过程).
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为10%.在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2.
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
分析 (1)由离子交换关系,氢氧根离子物质的量等于氯离子物质的量等于氢离子物质的量,据此计算0.54g FeClx中氯离子物质的量,进而计算x值;
(2)根据元素守恒计算氯化亚铁和氯化铁物质的量之比,进而计算氯化铁质量分数;
(3)铁离子氧化碘离子成碘单质的反应;
(4)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,氯元素被还原为氯离子,同时有水生成,配平书写离子方程式;K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,负极为锌失电子发生氧化反应,电极反应Zn-2e-+2OH-=Zn(OH)2;依据产物和电子守恒写出正极反应:FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;有正极反应和负极反应合并得到电池反应.
解答 解:(1)n(Cl)=n(Cl-)=n(H+)=n(OH-)=0.0250L×0.40 mol•L-1=0.010 mol,则$\frac{0.54g}{(56+35.5x)g/mol}$=0.010 mol,解得x=3,
故答案为:3;
(2)设混合物中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=$\frac{1}{1+9}$×100%=10%,在实验室中,FeCl2可用铁粉和盐酸反应,铁与氯气反应,故答案为:10%;盐酸;氯气;
(3)FeCl3与氢碘酸反应就是铁离子氧化碘离子成碘单质的反应,离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(4)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,氯元素被还原为氯离子,同时有水生成,反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-;3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
点评 本题考查了氧化还原反应、原电池的工作原理的应用、电极反应式的书写等,题目难度中等,熟悉氧化还原反应的规律、原电池的工作原理是解题关键,注意培养阅读材料获取信息的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 7.8g 苯中含有的单键数目为0.9NA | |
| B. | 1 mol Cl2溶于水,与水反应时电子转移数目为1 NA | |
| C. | 在298K 1.01×105pa下,22 g CO2和N2O混合气体中,所占的体积大于11.2升 | |
| D. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA |
| A. |  | B. |  | C. |  | D. |  |
| A. | 同温同压下,相同体积的任何物质,其物质的量必相等 | |
| B. | 相同条件下的一氧化碳气体和氮气,若体积相等,则质量也相等 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 在不同条件下,等物质的量的甲烷和一氧化碳所含的分子数一定不等 |
| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2.
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
①C与O2 ②Na与O2 ③Fe与Cl2
④AlCl3溶液与氨水 ⑤CO2与NaOH溶液 ⑥Cu与硝酸.
| A. | 除③外 | B. | 除④外 | C. | 除③④外 | D. | 除②⑥外 |