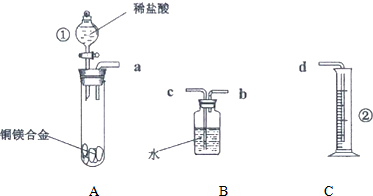
题目内容
9.往含Fe3+、H+、NO3-的混合液中加入少量SO${\;}_{3}^{2-}$,充分反应后,下列表示该反应的离子方程式正确的是( )| A. | 2Fe3++SO${\;}_{3}^{2-}$+H2O═2Fe2++SO${\;}_{4}^{2-}$+2H+ | |
| B. | 2H++SO${\;}_{3}^{2-}$═H2O+SO2↑ | |
| C. | 2H++2NO${\;}_{3}^{-}$+3SO${\;}_{3}^{2-}$═3SO${\;}_{4}^{2-}$+2NO↑+H2O | |
| D. | 2Fe3++3SO${\;}_{3}^{2-}$+3H2O═2Fe(OH)3↓+3SO2↑ |
分析 三价铁离子、硝酸根离子都具有氧化性,都能氧化亚硫酸根离子,硝酸根离子在酸性环境下氧化性强于三价铁离子,所以通入亚硫酸根离子,先与硝酸根离子反应,若亚硫酸根剩余再与三价铁离子反应,据此解答.
解答 解:三价铁离子、硝酸根离子都具有氧化性,都能氧化亚硫酸根离子,硝酸根离子在酸性环境下氧化性强于三价铁离子,所以通入亚硫酸根离子,先与硝酸根离子反应,若亚硫酸根剩余再与三价铁离子反应,题干中亚硫酸根离子少量,所以只有硝酸根离子反应,离子方程式:2H++2NO3-+3SO32-═3SO42-+2NO↑+H2O,
故选:C.
点评 本题考查了离子方程式的书写,明确氧化还原反应的先后顺序,熟悉三价铁离子、硝酸根离子氧化性强弱是解题关键,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
20.下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②用过量的氨水除去Fe3+溶液中的少量Al3+
③Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2
④铝粉与氧化镁共热可制取金属镁
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②用过量的氨水除去Fe3+溶液中的少量Al3+
③Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2
④铝粉与氧化镁共热可制取金属镁
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
17.常温下,某溶液A中可能含有NH4+、K+、Na+、Al3+、Fe2+、Fe3+、CO32-、SO32-、Cl-、SO42-,现取该溶液进行有关实验,实验结果如图所示:
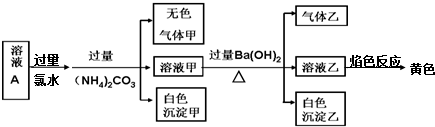
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 溶液中一定有SO42-,可能有K+、Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
4.对于下列物质中制定元素化合价分析错误的是( )
| A. | 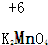 | B. | 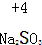 | C. | 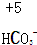 | D. | 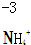 |
14.下列说法正确的是( )
| A. | 向饱和食盐水中加入少量的浓盐酸,看不到明显的现象 | |
| B. | 将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小 | |
| C. | 在0.01mol/L NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解 | |
| D. | CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡:CaCO3?Ca2++CO${\;}_{3}^{2-}$ |
1.某学习小组需0.10mol/L的Na2CO3溶液450mL.下列有关说法正确的是( )
| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
18.配制450mL、0.1mol/L Na2CO3溶液,需要Na2CO3•10H2O质量为( )
| A. | 14.3g | B. | 21.2g | C. | 10.6g | D. | 12.9g |
19.下列物质中属于氧化物的是( )
| A. | H2O | B. | N2 | C. | O3 | D. | KMnO4 |