题目内容
13. CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
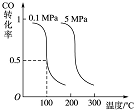
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
(1)该反应属于放热反应(填“吸热”或“放热”).
(2)100℃时,该反应的平衡常数:K=$\frac{{b}^{2}}{{a}^{2}}$(用a、b 的代数式表示).
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率增大(填“增大”“不变”或“减小”)
分析 (1)由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,据此判断;
(2)化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){•c}^{2}({H}_{2})}$,根据CO的转化率,利用三段式计算出平衡时各组分的物质的量,进而求出平衡时各组分的浓度,代入平衡常数计算;
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动.
解答 解:(1)由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,则正反应为放热反应;
故答案为:放热;
(2)100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
CO(g)+2H2(g)?CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
所以平衡时,CO的浓度为$\frac{0.5a}{b}$=$\frac{a}{2b}$,H2的浓度为$\frac{a}{b}$=mol/L,CH3OH的浓度为$\frac{0.5a}{b}$=$\frac{a}{2b}$,100℃时该反应的平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){•c}^{2}({H}_{2})}$=$\frac{\frac{a}{2b}}{\frac{a}{2b}×(\frac{a}{b})^{2}}$=$\frac{{b}^{2}}{{a}^{2}}$;故答案为:$\frac{{b}^{2}}{{a}^{2}}$;
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动,CO的转化率增大.
故答案为:增大.
点评 本题考查化学平衡图象、化学平衡有关计算、化学平衡常数、影响化学平衡的因素等知识点,是对知识的综合运用,应加强平时知识的积累,应注意图象的利用来分析解决问题,图象中的信息是解答本题的关键,题目难度中等.

| A. | 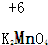 | B. | 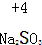 | C. | 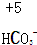 | D. | 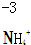 |
| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y.此反应的化学方程式是2CO+SO2=S+2CO2.
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
| A. | 14.3g | B. | 21.2g | C. | 10.6g | D. | 12.9g |
①C与O2 ②Na与O2 ③Fe与Cl2
④AlCl3溶液与氨水 ⑤CO2与NaOH溶液 ⑥Cu与硝酸.
| A. | 除③外 | B. | 除④外 | C. | 除③④外 | D. | 除②⑥外 |
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | l mol金刚石中,含2 mol C-C键 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子化合物 |
| A. | 使酚酞变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | NaClO和NaCl混合溶液中:H+、NH4+、SO42-、Br- | |
| C. | 氯化亚铁溶液中:Na+、Ba2+、Br-、NO3- | |
| D. | 0.1 mol•L-1的NaAlO2 溶液:H+、Na+、Cl-、SO42- |