题目内容
6.下列叙述正确的是( )| A. | 氯化铯晶体中,每1个Cs+与其它8个Cs+等距离紧邻 | |
| B. | 金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子 | |
| C. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
分析 A.CsCl晶胞中每个Cs+与其它6个Cs+等距离紧邻;
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有6个碳原子;
C.原子晶体中,晶体熔沸点与原子半径成反比;
D.在分子中,中心原子价电子数+化合价的绝对值=8时,该分子中各原子达到8电子稳定结构,但氢化物除外.
解答 解:A.CsCl晶胞中每个Cs+与其它6个Cs+等距离紧邻,但每个Cs+周围等距离的氯离子个数是8,故A错误;
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有6个碳原子,但每个C原子形成四个共价键,故B错误;
C.原子晶体中,晶体熔沸点与原子半径成反比,原子半径C-C<C-Si<Si-Si,所以熔点由高到低的顺序是:金刚石>碳化硅>晶体硅,故C正确;
D.PCl3中P元素化合价+P原子最外层电子数=3+5=8,所以该分子中所有原子都达到8电子稳定结构;BCl3中B原子化合价+B原子最外层电子数=3+3=6,所以该分子中B原子最外层不能达到8电子稳定结构,故D错误;
故选C.
点评 本题考查物质结构和性质,明确晶胞结构特点、原子晶体熔沸点影响因素、8电子稳定结构判断方法即可解答,为高频考点,易错点是配位数的计算方法,熟练掌握常见典型晶体结构,题目难度不大.

练习册系列答案
相关题目
16.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | CH≡C-CH3 | B. | 对二甲苯 | C. | 对甲乙苯 | D. | 邻甲乙苯 |
17.常温下,某溶液A中可能含有NH4+、K+、Na+、Al3+、Fe2+、Fe3+、CO32-、SO32-、Cl-、SO42-,现取该溶液进行有关实验,实验结果如图所示:
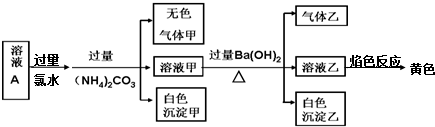
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 溶液中一定有SO42-,可能有K+、Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
14.下列说法正确的是( )
| A. | 向饱和食盐水中加入少量的浓盐酸,看不到明显的现象 | |
| B. | 将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小 | |
| C. | 在0.01mol/L NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解 | |
| D. | CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡:CaCO3?Ca2++CO${\;}_{3}^{2-}$ |
1.某学习小组需0.10mol/L的Na2CO3溶液450mL.下列有关说法正确的是( )
| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
11.常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A. | pH=l的溶液中:Fe2+、Na+、S042-、N03- | |
| B. | 水电离的c(H+)=l×l0-13mol/L的溶液中:NH4+、K+、Cl-、HC03- | |
| C. | KMn04溶液中:H+、Na+、S042-、C2H50H | |
| D. | 使甲基橙变红色的溶液中:NH4+、Al3+、N03-、Cl- |
18.配制450mL、0.1mol/L Na2CO3溶液,需要Na2CO3•10H2O质量为( )
| A. | 14.3g | B. | 21.2g | C. | 10.6g | D. | 12.9g |
15.硫酸钾和硫酸铝的混合溶液中,Al3+的浓度为0.4mol/L,SO${\;}_{4}^{2-}$的浓度为0.7mol/L,则K+的物质的量浓度为( )
| A. | 0.1mo/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.3mol/L |
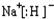 ;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.