题目内容
4.熔融盐燃料电池具有高的发电效率,因而受到重视.用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池.已知该电池总反应为:2CO+O2=2CO2.则下列说法中正确的是( )| A. | 通CO的一极是电池的正极 | |
| B. | 该电池工作过程中需不断补充CO和O2,CO2可循环利用 | |
| C. | 负极反应式为:O2+2CO2+4e-→2CO32- | |
| D. | 正极反应式为:2CO+2CO32-→4CO2+4e- |
分析 该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-=4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-.
解答 解:A.该燃料电池中通入CO的一极是负极,负极上失电子发生氧化反应,故A错误;
B.燃料电池中需要补充的是燃料和氧化剂,所以该电池工作过程中需不断补充CO和O2,而CO2可循环利用,故B正确;
C.负极上的电极反应式为2CO-4e-+2CO32-=4CO2,故C错误;
D.正极上的电极反应式为O2+4e-+2CO2=2CO32-,故D错误;
故选B.
点评 本题考查原电池原理,根据氢氧燃料电池来分析解答即可,注意电极反应式的正确书写,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.Y元素最高正价与最低负价的绝对值之差是4,Y元素与M元素形成化合物M2Y,并在水中电离出电子层结构相同的离子,该化合物是( )
| A. | KCl | B. | Na2S | C. | Na2O | D. | K2S |
15.下列事实,不能用勒夏特列原理解释的是( )
| A. | 氯水中有下列平衡Cl2+H2O?HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 | |
| D. | 合成NH3反应,为提高NH3的产率,理论上应采取降低温度的措施 |
12.有关溴乙烷的下列叙述中,正确的是( )
| A. | 溴乙烷不溶于水,其密度比水的小 | |
| B. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| C. | 溴乙烷与NaOH的醇溶液混合共热可生成乙烯 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
19.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由Y、Z、M三种元素形成的化合物一定只有共价键 |
16.现有前20号的元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代:这种同位素的符号是146C(用元素符号表示)
元素Z的离子结构示意图为 ,化合物WXY的电子式
,化合物WXY的电子式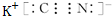 .
.
(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
| W | 灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色 |
元素Z的离子结构示意图为
 ,化合物WXY的电子式
,化合物WXY的电子式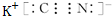 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
13.含有下列各组离子的溶液中,通入NH3后仍能大量共存的是( )
| A. | H+,Cu2+,Fe3+、SO4 2- | B. | Ba2+,Na+,Al3+、Cl- | ||
| C. | K+、Ag+ NH4+,NO3- | D. | Na+、K+、Br-、OH- |
 Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.
Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能. 金属铝、铁、铜及其化合物与生产、科研关系密切.
金属铝、铁、铜及其化合物与生产、科研关系密切.