题目内容
19.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ
2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g•L
-1;W的质子数是X、Y、Z、M四种元素质子数之和的
1212.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M |
| B. | XZ2、X2M2、W2Z2均为共价化合物 |
| C. | 由X元素形成的单质不一定是原子晶体 |
| D. | 由Y、Z、M三种元素形成的化合物一定只有共价键 |
分析 X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,则X为+4价,Z为-2价,可推出X、Y、Z分别为C、N、O三种元素;Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,则该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,可以确定M为H元素;W的质子数是X、Y、Z、M四种元素质子数之和的1212,则W的质子数为1212×(6+7+8+1)=11,故W为Na元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,则X为+4价,Z为-2价,可推出X、Y、Z分别为C、N、O三种元素;Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,则该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,可以确定M为H元素;W的质子数是X、Y、Z、M四种元素质子数之和的1212,则W的质子数为1212×(6+7+8+1)=11,故W为Na元素.
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,电子层越多原子半径越大,故原子半径:Na>C>N>O>H,即W>X>Y>Z>M,故A错误;
B.CO2、C2H2属于共价化合物,而Na2O2属于离子化合物,故B错误;
C.由碳元素形成的单质中,金刚石属于原子晶体,石墨为混合晶体,而C60等属于分子晶体,故C正确;
D.N、O、H均为非金属元素,三种元素形成的化合物一定含有共价键,可能含有离子键,如硝酸铵,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,涉及元素周期律、元素化合物性质与结构等,侧重考查学生的分析能力,推断元素是解题关键,难度中等.
练习册系列答案
相关题目

 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案 如图为锌、铜、硫酸铜溶液构成的原电池,请写出负极、以及电池总反应.
如图为锌、铜、硫酸铜溶液构成的原电池,请写出负极、以及电池总反应. .
. .
.
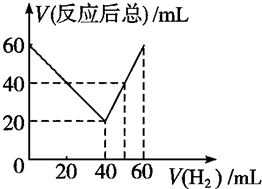 某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知x的数值为( )
某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知x的数值为( )