题目内容
9. Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.
Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.已知N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1查阅资料获知如下反应的热化学方程式.
N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
N2(g)+2O2(g)═2NO2(g)△H=+68kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是△S>0,NO分子中化学键的键能为631.5kJ•mol-1
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)═4CO2(g)+N2(g)△H=-1200kJ•mol-1.
Ⅱ.熔融状态下,钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2 $?_{充电}^{放电}$ Fe+2NaCl放电时,电池的正极反应式为Fe2++2e-=Fe;充电时,钠(写物质名称)电极接电源的负极;该电池的电解质为β-Al2O3.
分析 (1)①凡是△S>0的反应都有利于反应的自发进行,根据旧键断裂吸收的能量减去新键生成释放的能量值即为化学反应所吸收的能量,结合N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,N2(g)+O2(g)=2NO(g),△H=+180kJ•mol-1可以计算NO分子中化学键的键能;
②结合盖斯定律,利用后三个化学方程式就可以求出反应的焓变;
(2)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2 Fe+2NaCl,放电时,为原电池,Fe2+在正极放电生成Fe,;充电时,即为电解质池,电池的负极与外接电源的负极相连;电池的电解质为β-Al2O3.
Fe+2NaCl,放电时,为原电池,Fe2+在正极放电生成Fe,;充电时,即为电解质池,电池的负极与外接电源的负极相连;电池的电解质为β-Al2O3.
解答 解:(1)①根据影响反应能否自发进行的因素有△S、△H,凡是△S>0和△H<0的反应都有利于反应的自发进行,N2与O2反应生成NO或NO2时的△S>0,根据N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1可设NO分子中化学键的键能为X,则有:946kJ•mol-1+497kJ•mol-1-2X=180kJ•mol-1得:X=631.5kJ•mol-1,
故答案为:△S>0;631.5;
②已知N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1,N2(g)+2O2(g)=2NO2(g)△H2=+68kJ•mol-1,2C(s)+O2(g)=2CO(g)△H3=-221kJ•mol-1,C(s)+O2(g)=CO2(g)△H4=-393.5kJ•mol-1,根据盖斯定律,化学方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=4△H4-2△H3-△H2=-1200 kJ•mol-1,
故答案为:-1200kJ•mol-1;
(2)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2 Fe+2NaCl,放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe;充电时,即为电解质池,根据电解池原理,接电源负极的为电解池的阴极,在阴极上氧化剂发生还原反应,结合图可知,电极材料是钠,电池的电解质为β-Al2O3,
Fe+2NaCl,放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe;充电时,即为电解质池,根据电解池原理,接电源负极的为电解池的阴极,在阴极上氧化剂发生还原反应,结合图可知,电极材料是钠,电池的电解质为β-Al2O3,
故答案为:Fe2++2e-=Fe;钠;β-Al2O3.
点评 本题考查了盖斯定律的应用和反应热的计算、原电池和电解池原理的应用,题目难度中等,侧重于考查学生的分析能力和计算能力.

| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | NaCl的电子式为  |
| A. | Al3+、NO3-、K+、SO42ˉ | B. | Ca2+、H+、CO32ˉ、AlO2- | ||
| C. | OH-、SO42-、NH4+、Ag+ | D. | Fe2+、Mg2+、H+、NO3ˉ |
| A. | 通CO的一极是电池的正极 | |
| B. | 该电池工作过程中需不断补充CO和O2,CO2可循环利用 | |
| C. | 负极反应式为:O2+2CO2+4e-→2CO32- | |
| D. | 正极反应式为:2CO+2CO32-→4CO2+4e- |
| A. | 离子化合物一定易溶于水 | |
| B. | 离子化合物由非金属元素和金属元素共同组成 | |
| C. | 熔融状态下能够导电的物质,一定是离子化合物 | |
| D. | 离子化合物在固态时有离子存在,但不导电 |
| A. | ⅦA族元素是同周期中非金属性最强的元素 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 最外层电子数是2的元素一定位于元素周期表的第ⅡA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
| A. | 强碱性溶液中:Na+、K+、AlO2-、CO32- | |
| B. | 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+ | |
| C. | pH=7的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | c(OH-)=1×10-13 mol/L的溶液中:K+、Fe2+、Cl-、NO3- |
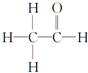 ,其PMR谱中有2个信号峰,其强度之比为3:1.
,其PMR谱中有2个信号峰,其强度之比为3:1. 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡状态,经测定增大压强p时,A的转化率随p而变化的曲线如图所示:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡状态,经测定增大压强p时,A的转化率随p而变化的曲线如图所示: