题目内容
2.工业生产苯乙烯是利用乙苯的脱氢反应: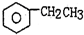 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$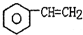 (g)+H2(g)△H<0
(g)+H2(g)△H<0针对上述反应,在其它条件不变时,下列说法正确的是( )
| A. | 加入适当催化剂,可以提高乙苯的转化率 | |
| B. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙本的转化率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量不变 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙稀选择恒压条件优于恒容条件 |
分析 由方程式可知,正反应为放热反应,且反应物气体的计量数小于生成物气体的计量数,则采取低压、低温有利于平衡向正向移动,以此解答该题.
解答 解:A.催化剂只改变反应速率,不影响平衡移动,故A错误;
B.在保持体积一定的条件下,充入较多的乙苯,相当于在原来的基础上缩小体积,压强增大,则平衡逆向移动,乙苯的转化率减小,故B错误;
C.加入乙苯至反应达到平衡过程中,气体的总质量不变,但物质的量逐渐增大,则混合气体的平均相对分子质量不断减小,故C错误.
D.反应物气体的计量数小于生成物气体的计量数,在恒容条件下,容器的压强不断增大,不利于平衡向正向移动,则工业生产苯乙烯选择恒压条件优于恒容条件,故D正确;
故选D.
点评 本题考查化学平衡的影响以及调控作用,侧重于化学与生产的联系的考查,为高频考点,注意把握反应的特点,注重相关基础知识的学习,难度不大.

练习册系列答案
相关题目
7.下列事实,可以证明氨水是弱碱的是( )
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1mol/L的氨水可以使酚酞试液变红 | |
| D. | 0.1mol/L的NH4Cl溶液的pH约为5 |
8.25℃时,将0.02 mol•L-1的HCOOH溶液与0.01mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7.则下列关系式中不正确的是( )
| A. | c(HCOO-)>c(Na+) | B. | c(HCOOH)<c(HCOO-) | ||
| C. | c(HCOOH)+c(HCOO-)=0.02mol•L-1 | D. | 2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-) |
10.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)═2C(g)+D(g) 已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 3v逆(C)=2v正(B) | D. | 气体的平均相对分子质量 |
17.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:BBa(OH)2 CHCl DAgNO3 EAl2(SO4)3
(2)E溶液中滴加过量氨水的离子方程式Al3++3NH3•H2O?Al(OH)3↓+3NH4+;
(3)请简述A中的阳离子的检验方法及实验现象:用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧,若焰色反应显黄色,证明是钠离子
(4)在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:BBa(OH)2 CHCl DAgNO3 EAl2(SO4)3
(2)E溶液中滴加过量氨水的离子方程式Al3++3NH3•H2O?Al(OH)3↓+3NH4+;
(3)请简述A中的阳离子的检验方法及实验现象:用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧,若焰色反应显黄色,证明是钠离子
(4)在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
7.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理.
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2 .
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
(3)为进一步确定实验I的产物,设计定量实验方案,如图所示:
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .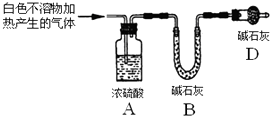
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2 .
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤, 加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加 入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在④ CO32-离子 |
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .

11.下列分散系不能发生丁达尔现象的是( )
| A. | 豆浆 | B. | 烟 | C. | 蔗糖溶液 | D. | 云、雾 |
12.碘在不同状态下(固态或气态)与氮气反应的热化学方程式如下所示:
①H2(g)+I2(?)?2HI(g)△H=+9.48kJ•mol-1
②H2(g)+I2(?)?2HI(g)△H=-26.48kJ•mol-1
下列刘断正确的是( )
①H2(g)+I2(?)?2HI(g)△H=+9.48kJ•mol-1
②H2(g)+I2(?)?2HI(g)△H=-26.48kJ•mol-1
下列刘断正确的是( )
| A. | ①中的为气态.②中的为固态 | |
| B. | ①的反应物总能量比②的反应物总能量低 | |
| C. | ①的产物比反应②的产物热稳定性更好 | |
| D. | 1mol固态碘升华时将吸热17kJ |
 A是化学实验室中最常见的有机物,能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,能进行如图所示的多种反应. CH3COOCH2CH3+H2O;反应④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
CH3COOCH2CH3+H2O;反应④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.