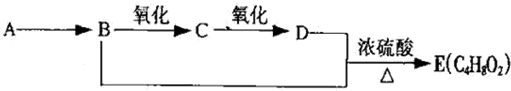
题目内容
7.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理.(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2 .
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤, 加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加 入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在④ CO32-离子 |
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .
分析 (1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3;
(2)依据实验Ⅱ的现象分析,镁条和碳酸氢钠溶液迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变分析出是氢气;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,根据二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量.
解答 解:(1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3,故答案为:Mg(OH)2 ;
(2)迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子,
故答案为:氢气;稀盐酸;产生气泡沉淀全部溶解;CO32-;
(3)B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为8.8g,设生成8.8g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X 8.8g
根据:$\frac{84}{44}$=$\frac{x}{8.8}$
解得X=16.8g,所以含有氢氧化镁质量为:22.6g-16.8g=5.8g;
碳酸镁和氢氧化镁物质的量之比为:$\frac{16,8g}{84g/mol}$:$\frac{5.8g}{58g/mol}$=0.2:0.1=2:1,白色不溶物的化学式为Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2,
故答案为:Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .
点评 本题考查全面,从定性和定量两个方面测定物质的种类,关键在于知道碳酸根离子与酸反应能产生二氧化碳,镁和氢离子反应生成氢气,题目难度较大.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$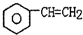 (g)+H2(g)△H<0
(g)+H2(g)△H<0针对上述反应,在其它条件不变时,下列说法正确的是( )
| A. | 加入适当催化剂,可以提高乙苯的转化率 | |
| B. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙本的转化率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量不变 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙稀选择恒压条件优于恒容条件 |
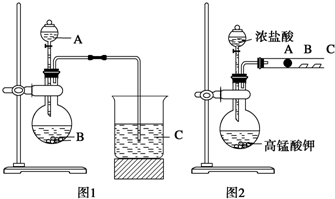
①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤溶解于水.
| A. | ②③ | B. | ③④ | C. | ①②③ | D. | ③④⑤ |
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:2:1 | D. | 1:1:1 |
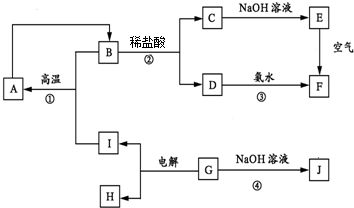
 ,E的化学式为Fe(OH)2.
,E的化学式为Fe(OH)2.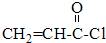 $→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3
$→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3 .(注明反应条件)
.(注明反应条件) 或CH2=CH-O-CH2-O-CH=CH2.
或CH2=CH-O-CH2-O-CH=CH2.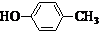 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为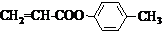 .
.