��Ŀ����
17������A��B��C��D��E����ǿ����ʣ�������ˮ�пɵ�������������ӣ��������Ӳ��ظ�����| ������ | H+��Na+��A13+��Ag+��Ba2+ |
| ������ | OH-��C1-��CO32-��NO3-��SO42- |
��A��Һ��E��Һ��Ӧ�����������г���������A��Һ��C��Һ��Ӧֻ������������������������ͬ����
��D��Һ������������Һ��Ӧ���ܲ��������� Cֻ����D��Ӧ����������
�Իش��������⣺
��1��д����ѧʽ��BBa��OH��2 CHCl DAgNO3 EAl2��SO4��3
��2��E��Һ�еμӹ�����ˮ�����ӷ���ʽAl3++3NH3•H2O?Al��OH��3��+3NH4+��
��3�������A�е������ӵļ��鷽����ʵ�������ýྻ�IJ�˿պȡ����Һ���ھƾ��ƻ��������գ�����ɫ��Ӧ�Ի�ɫ��֤����������
��4����100mL0.1mol•L-1E��Һ�У���μ���35mL 2mol•L-1NaOH��Һ�����յõ��������ʵ���Ϊ0.01 mol��
���� ��A��B����Һ�ʼ��ԣ�������ӵĹ����֪��ӦΪBa��OH��2��Na2CO3�е�һ�֣�C��D��E��Һ�����ԣ�ӦΪAgNO3����������HCl�е�һ�֣�
��A��Һ��E��Һ��Ӧ�����������г���������A��Һ��C��Һ��Ӧֻ�������������AΪNa2CO3��BΪBa��OH��2��EΪAl2��SO4��3��CΪHCl��
��D��Һ������������Һ��Ӧ���ܲ���������Cֻ����D��Ӧ������������DΪAgNO3��Ȼ�������ʵ����ʼ���ѧ���������
��� �⣺��A��B����Һ�ʼ��ԣ��������ӹ����֪��A��BӦΪBa��OH��2��Na2CO3�е�һ�֣�C��D��E��Һ�����ԣ�ӦΪAgNO3��Al2��SO4��3��HCl�е�һ�֣�
��A��Һ��E��Һ��Ӧ�����������г���������A��Һ��C��Һ��Ӧֻ�������������AΪNa2CO3��BΪBa��OH��2��EΪAl2��SO4��3��CΪHCl��
��D��Һ������������Һ��Ӧ���ܲ���������Cֻ����D��Ӧ������������DΪAgNO3��
��1�������Ϸ�����֪AΪNa2CO3��BΪBa��OH��2��CΪHCl��DΪAgNO3��EΪAl2��SO4��3��
�ʴ�Ϊ��Ba��OH��2��HCl��AgNO3��Al2��SO4��3��
��2��EΪAl2��SO4��3���μӹ�����ˮ��������������������Ӧ�����ӷ���ʽΪ��Al3++3NH3•H2O?Al��OH��3��+3NH4+��
�ʴ�Ϊ��Al3++3NH3•H2O?Al��OH��3��+3NH4+��
��3��AΪNa2CO3������A�е������������ӵķ���Ϊ�ýྻ�IJ�˿պȡ����Һ���ھƾ��ƻ��������գ�����ɫ��Ӧ�Ի�ɫ��֤���������ӣ�
�ʴ�Ϊ���ýྻ�IJ�˿պȡ����Һ���ھƾ��ƻ��������գ�����ɫ��Ӧ�Ի�ɫ��֤���������ӣ�
��4��EΪAl2��SO4��3��n��Al2��SO4��3��=0.1L��0.1mol/L=0.01mol��n��NaOH��=0.035L��2mol/L=0.07mol��
��n��Al3+��=0.02mol��n��OH-��=0.07mol��
������Al3++3OH-=Al��OH��3����
0.02mol 0.06mol 0.02mol
Al��OH��3+OH-=AlO2-+2H2O��
0.01mol 0.01mol
���Է�Ӧ������0.01molAl��OH��3��0.01molAlO2-���õ��������ʵ���Ϊ0.01mol��
�ʴ�Ϊ��0.01��
���� ���⿼���˳������ӵļ��飬������ѧ���ķ��������ͼ��������Ŀ��飬��ĿŨ���еȣ��������ӵĹ��桢���ӵ��������ƶ������ǽ����Ĺؼ���

| A�� | �����Ǻ����� | B�� | ���Ǻ���ѿ�� | C�� | ���ۺ���ά�� | D�� | ���ͻ��� |
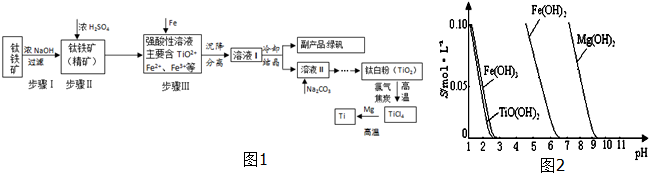
��1���������Ũ���ᷴӦ�IJ���֮һ��TiOSO4����Ӧ�����������ɣ���д����Ӧ��ѧ����ʽ��FeTiO3+H2SO4��Ũ��=TiOSO4+FeSO4+2H2O��
��2����֪��TiO2+��ˮ�⣬ֻ�ܴ�����ǿ������Һ�У� 25��ʱ�����ܵ�����ܽ�ȣ�s����pH��ϵ��ͼ2��TiO��OH��2�ܶȻ�Ksp=1��10-29������Һ�в���c��TiO2+��=1.0��10-5 mol•L-1���������ҺpH����Ϊ3������������мԭ���ǽ�Fe3+ת��ΪFe2+����ֹFe3+��TiO2+ͬʱ���ɳ�����
��3������Һ����м��ȣ�ͬʱ����Na2CO3��ĩ�����ü��ȴٽ�TiO2++2H2O?TiO��OH��2+2H+ ���ƣ�Na2CO3��ĩ����H+���ٽ�TiO2+ˮ�⣻
��4���Ѱ�����������̿�ڸ����½��з�Ӧ��������һ�ֿ�ȼ����ɫ���壬д���÷�Ӧ�Ļ�ѧ����ʽ
TiO2+2Cl2+2C $\frac{\underline{\;����\;}}{\;}$ TiCl4+2CO�����������̹����У�����ѭ��ʹ�õ�����ΪH2SO4���ѧʽ��
��5��Mg��ԭTiCl4��Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը���1412�漴�ɣ�
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
| A�� | XY2һ���Ƿ��Ӿ��� | B�� | XY2�ĵ���ʽ������ | ||
| C�� | XY2ˮ��Һ�����ܳʼ��� | D�� | X�����Ǣ�A����A���A��Ԫ�� |
 ��g��$\stackrel{560��}{?}$
��g��$\stackrel{560��}{?}$ ��g��+H2��g����H��0
��g��+H2��g����H��0���������Ӧ����������������ʱ������˵����ȷ���ǣ�������
| A�� | �����ʵ���������������ұ���ת���� | |
| B�� | �ڱ������һ���������£�����϶���ұ�����������ұ���ת���� | |
| C�� | �ڼ����ұ����ﵽƽ������У���������ƽ����Է����������� | |
| D�� | ����ƽ���ƶ��ĽǶȷ�������ҵ��������ϡѡ���ѹ�������ں������� |
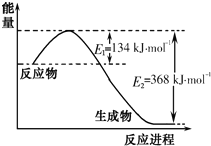
��1����ͼ��1mol NO2��g����1mol CO��g����Ӧ����CO2��g����NO��g�������������仯ʾ��ͼ��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽNO2��g��+CO��g��=NO��g��+CO2��g����H=-234 kJ•mol-1��
��2����֪��N2��g��+O2��g���T2NO��g����H=+180kJ•mol-1
2NO��g��+2CO��g���TN2��g��+2CO2��g����H=-746kJ•mol-1
��ӦCO��g��+$\frac{1}{2}$O2��g���TCO2��g���ġ�H=-283 kJ•mol-1
��3���ڹ̶�������ܱ������У�1.0��103kPaʱ��������Ӧ N2��g��+3H2��g��?2NH3��g����H��0����ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 51 | K1 | K2 |
�����и�����˵�������ϳɰ���Ӧһ���ﵽƽ��״̬����bc������ĸ��
a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
b��NH3��Ũ�ȱ��ֲ���
c��������ѹǿ���ֲ���
d�����������ܶȱ��ֲ��䣮
| A�� | 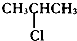 | B�� | CH3CH2Cl | C�� | 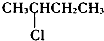 | D�� | CH3CH2CH2Cl |