题目内容
8.25℃时,将0.02 mol•L-1的HCOOH溶液与0.01mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7.则下列关系式中不正确的是( )| A. | c(HCOO-)>c(Na+) | B. | c(HCOOH)<c(HCOO-) | ||
| C. | c(HCOOH)+c(HCOO-)=0.02mol•L-1 | D. | 2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-) |
分析 25℃时,将0.02 mol•L-1的HCOOH溶液与0.01mol•L-1的NaOH溶液等体积混合,HCOOH+NaOH=HCOONa+H2O,得到等浓度的HCOOH和HCOONa,所得溶液的pH<7,说明电离大于水解,结合溶液中电荷守恒、物料守恒计算分析;
解答 解:25℃时,将0.02 mol•L-1的HCOOH溶液与0.01mol•L-1的NaOH溶液等体积混合,HCOOH+NaOH=HCOONa+H2O,得到等浓度的HCOOH和HCOONa,所得溶液的pH<7,说明电离大于水解,结合溶液中电荷守恒、物料守恒分析,
A、上述分析可知溶液显酸性甲酸电离大于甲酸根离子水解,c(HCOO-)>c(Na+),故A正确;
B、上述分析可知溶液显酸性甲酸电离大于甲酸根离子水解,c(HCOOH)<c(HCOO-),故B正确
C、溶液中存在物料守恒c(HCOOH)+c(HCOO-)=0.01mol•L-1 ,故C错误;
D、溶液中存在物料守恒c(HCOOH)+c(HCOO-)=2c(Na+),电荷守恒c(H+)+c(Na+)=c(HCOO-)+c(OH-),计算得到,2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-),故D正确;
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较,电荷守恒、物料守恒的计算分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
18.HClO是比H2CO3还弱的酸,当反应Cl2+H2O?HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( )
| A. | NaOH固体 | B. | NaCl固体 | C. | H2O | D. | CaCO3固体 |
5.金属钛(Ti)硬度大、熔点高、常温下耐酸碱腐蚀,被誉为“未来金属”.以钛铁矿[主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质]为主要原料冶炼金属钛并获得副产品绿矾(FeSO4•7H2O)的工业生产流程如图1:
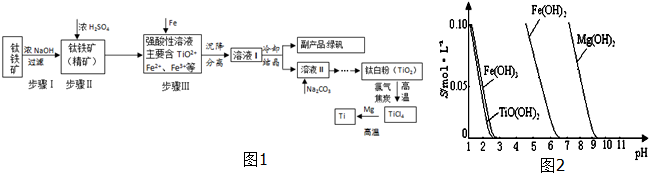
(1)钛铁矿精矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.试写出反应化学方程式:FeTiO3+H2SO4(浓)=TiOSO4+FeSO4+2H2O;
(2)已知:TiO2+易水解,只能存在于强酸性溶液中. 25℃时,难溶电解质溶解度(s)与pH关系如图2,TiO(OH)2溶度积Ksp=1×10-29,若溶液中残留c(TiO2+)=1.0×10-5 mol•L-1,则调节溶液pH至少为3;步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
(3)对溶液Ⅱ进行加热,同时加入Na2CO3粉末的作用加热促进TiO2++2H2O?TiO(OH)2+2H+ 右移,Na2CO3粉末消耗H+,促进TiO2+水解;
(4)钛白粉与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,写出该反应的化学方程式
TiO2+2Cl2+2C $\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO,该生产流程工艺中,可以循环使用的物质为H2SO4(填化学式)
(5)Mg还原TiCl4反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(6)为了测定绿矾中所含结晶水个数,可取样品进行灼烧,在灼烧时需要仪器除了三脚架、坩埚、石棉网、坩埚钳、酒精喷灯外还需要泥三角、玻璃棒.(填仪器名称)

(1)钛铁矿精矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.试写出反应化学方程式:FeTiO3+H2SO4(浓)=TiOSO4+FeSO4+2H2O;
(2)已知:TiO2+易水解,只能存在于强酸性溶液中. 25℃时,难溶电解质溶解度(s)与pH关系如图2,TiO(OH)2溶度积Ksp=1×10-29,若溶液中残留c(TiO2+)=1.0×10-5 mol•L-1,则调节溶液pH至少为3;步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
(3)对溶液Ⅱ进行加热,同时加入Na2CO3粉末的作用加热促进TiO2++2H2O?TiO(OH)2+2H+ 右移,Na2CO3粉末消耗H+,促进TiO2+水解;
(4)钛白粉与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,写出该反应的化学方程式
TiO2+2Cl2+2C $\frac{\underline{\;高温\;}}{\;}$ TiCl4+2CO,该生产流程工艺中,可以循环使用的物质为H2SO4(填化学式)
(5)Mg还原TiCl4反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
2.工业生产苯乙烯是利用乙苯的脱氢反应: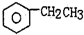 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$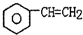 (g)+H2(g)△H<0
(g)+H2(g)△H<0
针对上述反应,在其它条件不变时,下列说法正确的是( )
 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$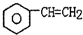 (g)+H2(g)△H<0
(g)+H2(g)△H<0针对上述反应,在其它条件不变时,下列说法正确的是( )
| A. | 加入适当催化剂,可以提高乙苯的转化率 | |
| B. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙本的转化率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量不变 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙稀选择恒压条件优于恒容条件 |
3.短周期主族元素X、Y、Z的原子序数依次增大,在周期表中分处三个不同周期.X与Z同主族,X与Z的原子序数之和为12.下列说法中不正确的是( )
| A. | 离子半径 Z>X | B. | 最外层电子数 Z>Y | ||
| C. | 金属性 Z>X | D. | 原子半径 Z>Y |
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
 ,E的化学式为Fe(OH)2.
,E的化学式为Fe(OH)2.