题目内容
19.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.180 | 0.110 | 0.080 | 0.074 | 0.146 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X、Y、R的最高价氧化物的水化物两两之间能发生反应 |
分析 短周期元素中,Y和M的化合价都有-2价,应为ⅥA族元素,Y的最高价为+6价,则Y为S元素,M为O元素;R的化合价为+3价,为ⅢA族元素,原子半径大于S,故R为Al元素,X的化合价为+1价,处于IA族,原子半径大于Al,且与Al相差较大,则X为Na;Z有+5、-3价,处于VA族,原子半径小于S,由O元素相差不大,故Z为N元素,据此解答.
解答 解:短周期元素中,Y和M的化合价都有-2价,应为ⅥA族元素,Y的最高价为+6价,则Y为S元素,M为O元素;R的化合价为+3价,为ⅢA族元素,原子半径大于S,故R为Al元素,X的化合价为+1价,处于IA族,原子半径大于Al,且与Al相差较大,则X为Na;Z有+5、-3价,处于VA族,原子半径小于S,由O元素相差不大,故Z为N元素.
A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2->O2->Al3+,故A正确;
B.Z与M组成的NO2等形成酸雨的原因之一,故B正确;
C.将SO2通入BaCl2溶液中,亚硫酸不能与氯化钡反应,没有大量白色沉淀产生,故C错误;
D.X、Y、R的最高价氧化物的水化物分别为NaOH、硫酸、氢氧化铝,两两之间能发生反应,故D正确,
故选:C.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,根据元素化合价、原子半径推断元素是解答该题的关键,注意元素周期律的递变规律的应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.工业合成氨反应为:N2+3H2?2NH3 (正反应为放热反应),从理论上讲,下列操作不利于工业合成氨的是( )
| A. | 升高温度 | B. | 增大压强 | C. | 使用催化剂 | D. | 定时分离出氨 |
10.用NA表示阿伏加德罗常数,下列的叙述正确的是( )
| A. | 在2L0.15 mol/L K2SO4溶液中,含有K+和SO42-的总数为0.9NA | |
| B. | 在标准状况下46 g NO2含有NA个分子 | |
| C. | ag某气体含有分子数为b,则c g该气体在标准状况下的体积是$\frac{22.4bc}{a{N}_{A}}$L | |
| D. | 当稀硝酸跟5.6 g Fe反应完全时,电子转移一定是0.3NA |
7.室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙两烧杯中溶液的描述不正确的是( )
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)=═c(OH-)乙 | |
| C. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,消耗NaOH溶液的体积不相同 |
14.下列有关化学用语使用正确的是( )
| A. | CH4分子的比例模型: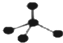 | B. | NH4Cl的电子式: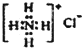 | ||
| C. | S2-结构示意图: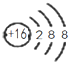 | D. | 聚丙烯的结构简式为: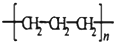 |
4. 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
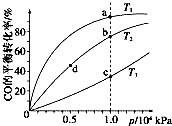
(4)反应①按照相同的物质的量投料,测得CO在不
同温度下的平衡转化率与压强的关系如右图所示.
下列说法正确的是 (填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不
同温度下的平衡转化率与压强的关系如右图所示.
下列说法正确的是 (填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
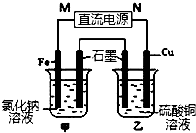 如图装置中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液.向甲烧杯中滴入几滴酚酞,反应一段时间后,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为变小(选填“变大”、“变小”、“不变”).通电一段时间后(溶液中还有CuSO4),停止通电.若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).
如图装置中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液.向甲烧杯中滴入几滴酚酞,反应一段时间后,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为变小(选填“变大”、“变小”、“不变”).通电一段时间后(溶液中还有CuSO4),停止通电.若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).