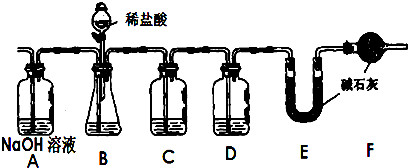
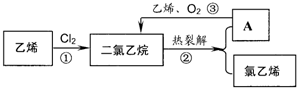
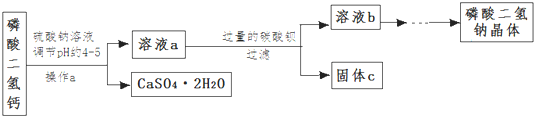
题目内容
11.某表面被氧化的镁条质量为6g,用500mL 1mol•L-1盐酸可以将该镁条完全溶解,忽略体积变化,测得所得溶液中c(H+)=0.08mol•L-1.接着,加入Na2O2粉末ag,恰好将溶液中的镁元素全部转化为Mg(OH)2沉淀.计算:(1)镁条中MgO的物质的量.
(2)加入 Na2O2粉末的质量.
分析 (1)某表面被氧化的镁条,为Mg与MgO混合物,与盐酸反应生成MgCl2,测得所得溶液中c(H+)=0.08mol•L-1,HCl有剩余,n总(HCl)=n(H+)=0.5L×0.08mol/L=0.04mol,根据氯离子守恒2n(MgCl2)+n剩余(HCl)=n总(HCl),根据Mg元素守恒计算Mg元素总质量,进而计算O元素质量,根据氧元素守恒n(MgO)=n(O);
(2)加入 Na2O2粉末的质量,恰好将溶液中的镁元素全部转化为Mg(OH)2沉淀,所得溶液中溶质为NaCl,根据氯离子守恒n(NaCl)=n总(HCl),再根据钠离子守恒n(Na2O2)=$\frac{1}{2}$n(NaCl),根据m=nM计算m(Na2O2).
解答 解:(1)某表面被氧化的镁条,为Mg与MgO混合物,与盐酸反应生成MgCl2,测得所得溶液中c(H+)=0.08mol•L-1,HCl有剩余,n总(HCl)=n(H+)=0.5L×0.08mol/L=0.04mol,根据氯离子守恒:2n(MgCl2)+n剩余(HCl)=n总(HCl),则2n(MgCl2)+0.04mol=0.5L×1mol/L,解得n(MgCl2)=0.23mol,根据Mg元素守恒,可知Mg元素总质量为0.23mol×24g/mol=5.52g,O元素质量6g-5.52g=0.48g,根据氧元素守恒n(MgO)=n(O)=$\frac{0.48g}{16g/mol}$=0.03mol,
答:镁条中MgO的物质的量为0.03mol;
(2)加入 Na2O2粉末的质量,恰好将溶液中的镁元素全部转化为Mg(OH)2沉淀,所得溶液中溶质为NaCl,根据氯离子守恒n(NaCl)=n总(HCl)=0.5L×1mol/L=0.5mol,根据钠离子守恒n(Na2O2)=$\frac{1}{2}$n(NaCl)=0.25mol,则m(Na2O2)=0.25mol×78g/mol=19.5g,
答:加入 Na2O2粉末的质量为19.5g.
点评 本题考查混合物计算,注意利用守恒思想进行解答,较好的考查学生分析计算能力,难度中等.

| A. | H2SO4 | B. | CuSO4 | C. | HCl | D. | KCl |
| A. | 常温常压下,1 mol Fe与足量稀HNO3反应,转移电子数目一定为为3NA | |
| B. | 0.1 mol/L NaHCO3溶液中含有Na+数目为0.1NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 常温下,1 mol Fe与足量浓硫酸反应,转移电子数目一定为为3NA |
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.180 | 0.110 | 0.080 | 0.074 | 0.146 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X、Y、R的最高价氧化物的水化物两两之间能发生反应 |
| A. | 碘的升华 | B. | 生石灰溶于水 | C. | 镁与稀盐酸反应 | D. | 氨气分解 |