题目内容
10.用NA表示阿伏加德罗常数,下列的叙述正确的是( )| A. | 在2L0.15 mol/L K2SO4溶液中,含有K+和SO42-的总数为0.9NA | |
| B. | 在标准状况下46 g NO2含有NA个分子 | |
| C. | ag某气体含有分子数为b,则c g该气体在标准状况下的体积是$\frac{22.4bc}{a{N}_{A}}$L | |
| D. | 当稀硝酸跟5.6 g Fe反应完全时,电子转移一定是0.3NA |
分析 A、求出硫酸钾的物质的量n=CV,然后根据1mol硫酸钾中含2mol钾离子和1mol硫酸根来分析;
B、NO2气体中存在平衡:2NO2?N2O4,导致分子个数减小;
C、根据n=$\frac{N}{{N}_{A}}$计算ag气体的物质的量,质量之比等于其物质的量之比,据此计算cg该气体的物质的量,根据V=n×Vm来计算体积;
D、求出铁的物质的量,然后根据铁与硝酸反应时铁可能变为+2价也可能变为+3价来分析.
解答 解:A、溶液中硫酸钾的物质的量n=CV=0.15mol/L×2L=0.3mol,而1mol硫酸钾中含2mol钾离子和1mol硫酸根,故0.3mol硫酸钾中含0.6mol钾离子和0.3mol硫酸根,即共含0.9NA个离子,故A正确;
B、46g气体中二氧化氮的物质的量为1mol,但由于NO2气体中存在平衡:2NO2?N2O4,导致分子个数减小,故分子个数小于NA个,故B错误;
C、a克某气体中含有的分子数为b,则c克气体含有的分子数为$\frac{cb}{a}$,c克该气体的物质的量为$\frac{\frac{bc}{a}}{{N}_{A}}$=$\frac{bc}{a{N}_{A}}$mol,在标准状况下Vm=22.4L/mol,则cg该气体的体积为$\frac{bc}{a{N}_{A}}$mol×22.4L/mol=$\frac{22.4bc}{a{N}_{A}}$L,故C正确;
D、5.6g铁的物质的量为0.1mol,而铁与硝酸反应时,若铁过量则铁变为+2价,若铁不足则铁变为+3价,故0.1mol铁转移的电子数可能为0.2NA或0.3NA,故D错误.
故选AC.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

| A. | H2SO4 | B. | CuSO4 | C. | HCl | D. | KCl |
| A. | 把铁放入硫酸铜溶液中 | B. | 加热氧化铝 | ||
| C. | 铝粉与氧化铁高温共热 | D. | 电解熔融氯化钠 |
| A. | $\frac{100b}{a}$g | B. | $\frac{200b}{a}$g | C. | $\frac{100b}{a+b}$g | D. | $\frac{100(a+b)}{a}$g |
| A. | 常温常压下,1 mol Fe与足量稀HNO3反应,转移电子数目一定为为3NA | |
| B. | 0.1 mol/L NaHCO3溶液中含有Na+数目为0.1NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 常温下,1 mol Fe与足量浓硫酸反应,转移电子数目一定为为3NA |
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.180 | 0.110 | 0.080 | 0.074 | 0.146 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X、Y、R的最高价氧化物的水化物两两之间能发生反应 |
| A. | 碘的升华 | B. | 生石灰溶于水 | C. | 镁与稀盐酸反应 | D. | 氨气分解 |
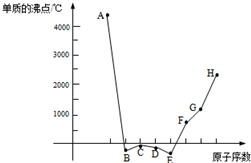 A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图所示.
A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图所示.