题目内容
9.工业合成氨反应为:N2+3H2?2NH3 (正反应为放热反应),从理论上讲,下列操作不利于工业合成氨的是( )| A. | 升高温度 | B. | 增大压强 | C. | 使用催化剂 | D. | 定时分离出氨 |
分析 根据反应N2+3H2?2NH3,正反应是气体积减少的反应,正反应为放热反应的特点,根据影响化学平衡移动的因素以及影像化学反应速率的因素来回答.
解答 解:A、正反应是放热反应,升高温度平衡逆向移动,所以不利于工业合成氨,故A正确;
B、增大压强平衡正向移动,所以利于工业合成氨,故B错误;
C、使用催化剂平衡不移动,但加快化学反应的速率,所以利于工业合成氨,故C错误;
D、定时分离出氨,减少生成物的浓度平衡正向移动,所以利于工业合成氨,故D错误;
故选A.
点评 本题考查学生影响化学反应速率的因素以及化学平衡的移动方向等方面的知识,属于综合知识的考查,注重化学联系实际工业生产原理,难度不大.

练习册系列答案
相关题目
4.工业上制取镁单质,常将镁蒸气在下列哪种气体环境中冷却( )
①O2
②CO2
③空气
④Ar
⑤N2.
①O2
②CO2
③空气
④Ar
⑤N2.
| A. | ②④⑤ | B. | 只有④ | C. | ③④⑤ | D. | 全部 |
1.用铂电极电解下列溶液,当耗电量相同时,阴极和阳极上同时都有气体产生,且溶液的pH下降的是( )
| A. | H2SO4 | B. | CuSO4 | C. | HCl | D. | KCl |
18.下列各冶炼方法中,不能制得相应金属的是( )
| A. | 把铁放入硫酸铜溶液中 | B. | 加热氧化铝 | ||
| C. | 铝粉与氧化铁高温共热 | D. | 电解熔融氯化钠 |
19.几种短周期元素的原子半径及主要化合价如下表:
根据上表下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.180 | 0.110 | 0.080 | 0.074 | 0.146 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X、Y、R的最高价氧化物的水化物两两之间能发生反应 |
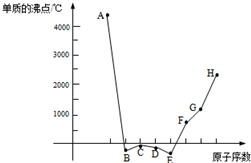 A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图所示.
A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图所示.