题目内容
14.下列有关化学用语使用正确的是( )| A. | CH4分子的比例模型: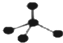 | B. | NH4Cl的电子式: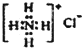 | ||
| C. | S2-结构示意图: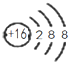 | D. | 聚丙烯的结构简式为: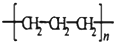 |
分析 A、甲烷为正面体结构,由原子相对大小表示空间结构为比例模型;
B、氯离子最外层电子未标出;
C、微粒符号以及微粒结构示意图,要结合原子结构来进行分析,核外电子与核内质子数的关系:里多外少阳离子,里外相等是原子,里少外多阴离子;
D、聚丙烯是由丙烯不饱和的碳原子相互加成得到的,注意原子之间连接;
解答 解:A、甲烷为正面体结构,由原子相对大小表示空间结构为比例模型,则CH4分子的比例模型为 ,选项中为球棍模型,故A错误;
,选项中为球棍模型,故A错误;
B、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故B错误;
,故B错误;
C、硫元素的原子序数为16,S2-的离子结构示意图为: ,故C正确;
,故C正确;
D、聚丙烯为高分子化合物,聚丙烯是由丙烯不饱和的碳原子相互加成得到的,其结构简式为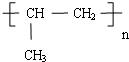 ,故D错误;
,故D错误;
故选C.
点评 本题考查了化学用语,要熟练掌握常用的化学用语,注意不同化学用语的书写要求,掌握基础是解题关键,题目较简单.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
4.工业上制取镁单质,常将镁蒸气在下列哪种气体环境中冷却( )
①O2
②CO2
③空气
④Ar
⑤N2.
①O2
②CO2
③空气
④Ar
⑤N2.
| A. | ②④⑤ | B. | 只有④ | C. | ③④⑤ | D. | 全部 |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,1 mol Fe与足量稀HNO3反应,转移电子数目一定为为3NA | |
| B. | 0.1 mol/L NaHCO3溶液中含有Na+数目为0.1NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 常温下,1 mol Fe与足量浓硫酸反应,转移电子数目一定为为3NA |
9.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
19.几种短周期元素的原子半径及主要化合价如下表:
根据上表下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.180 | 0.110 | 0.080 | 0.074 | 0.146 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X、Y、R的最高价氧化物的水化物两两之间能发生反应 |
4.为了配制c(Na+):c(HCO3-)=1:1的溶液,可向NaHCO3溶液中( )
| A. | 通入HCl气体 | B. | 加入适量氢氧化钠固体 | ||
| C. | 加入适量KHCO3 | D. | 加入适量Na2CO3晶体 |