题目内容
1.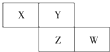 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |
分析 由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,X的单质在空气中含量最高,则X为N元素,故Y为O元素,Z为S元素、W为Cl,据此解答.
解答 解:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是次外层电子数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,
A.非金属性X<Y,则X的气态氢化物比Y的稳定性弱,故A错误;
B.非金属性越强,则最高价氧化物对应水化物的酸性越强,非金属性:W>Z,则W的最高价氧化物对应水化物的酸性比Z的强,故B正确;
C.同主族从上到下非金属性减弱,非金属性Z<Y,故C正确;
D.X为N元素,Y为O元素,二者的化合物NO,难溶于水,故D错误,
故选AD.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
11.在室温下,下列各组微粒在溶液中能大量共存的是( )
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
12.下列有关说法正确的是( )
| A. | 电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变 | |
| B. | NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强 | |
| C. | SO3(g)+H2O(l)═H2SO4(aq)在常温下能自发进行,则该反应的△H<0 | |
| D. | 0.1 mo1•L-1 CH3COOH溶液加水稀释后,溶液中$\frac{{c(CH}_{3}C{OO}^{-1})}{{c(CH}_{3}COOH)}$的值减小 |
16.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 1 L 1mol/L的盐酸含有NA个HCl分子 | |
| C. | 标准状况下,33.6 L四氯化碳中含有氯原子的数目为6NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
13.下列溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
10.下列说法正确的是( )
| A. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置,分液,得到下层液体 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| D. | 用pH计分别测定0.1mol/L的FeCl3和0.01mol/L的FeCl3的pH,可以比较浓度对盐类水解程度的影响 |
11.以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.4kJ/mol;完成下列填空:
(1)上述反应在高温(填高温、低温、任何温度)下能自发进行.
(2)该反应平衡常数K的表达式K=$\frac{{c}^{4}(N{H}_{3})•{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})}$.
(3)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则ac.
a.平衡常数K增大 b.H2O的浓度减小 c.容器内的压强增大 d.v逆(O2)减小
(4)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见表:
第四组实验中以NH3表示反应的速率是33×10-7mol/L•h,与前三组相比,NH3 生成量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
(5)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡理论解释上述实验现象饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生.
②向盐酸中滴加氨水过量至溶液呈中性,则离子浓度的关系是c(NH4+)>c(OH-)>c(Cl-)>c(H+).
(1)上述反应在高温(填高温、低温、任何温度)下能自发进行.
(2)该反应平衡常数K的表达式K=$\frac{{c}^{4}(N{H}_{3})•{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})}$.
(3)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则ac.
a.平衡常数K增大 b.H2O的浓度减小 c.容器内的压强增大 d.v逆(O2)减小
(4)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
(5)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是NH4Cl.请用电离平衡理论解释上述实验现象饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀,加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生.
②向盐酸中滴加氨水过量至溶液呈中性,则离子浓度的关系是c(NH4+)>c(OH-)>c(Cl-)>c(H+).

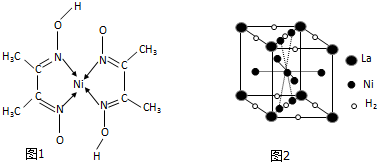 镍及其化合物应用广泛
镍及其化合物应用广泛 ) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.
) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.