题目内容
16.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 1 L 1mol/L的盐酸含有NA个HCl分子 | |
| C. | 标准状况下,33.6 L四氯化碳中含有氯原子的数目为6NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
分析 A、亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气;
B、HCl为强电解质,在溶液中电离;
C、标况下,四氯化碳为液态;
D、此反应中生成的2molHNO3完全来自于NO3-,NH4+和NO3-发生归中反应.
解答 解:A、1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故A错误;
B、HCl为强电解质,在溶液中电离,不存在HCl分子,故B错误;
C、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算,故C错误;
D、此反应中生成的2molHNO3完全来自于NO3-,5molNH4+和3molNO3-发生归中反应生成4mol氮气,故转移15mol电子时生成4mol氮气,即生成28 g N2时即1mol,转移的电子数目为3.75NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
6.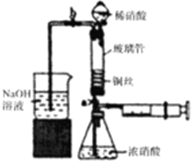 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
①根据上表得出的结论是温度越低(填“高”或“低”),进入试管中的溶液越多;
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3];
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状;
Ⅲ.按如图所示装置连接仪器,检查气密性,装入化学试剂.
(1)写出Cu丝在空气中形成铜绿的化学反应方程式2Cu+CO2+O2+H2O=Cu2(OH)2CO3;
(2)将铜丝烧成螺旋状的原因是增大铜丝与酸的接触面积,提高化学反应速率,写出过程Ⅲ中检查气密性的方法打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好;
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是产生红棕色气体,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开,关闭a,取下注射器;
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生,稀硝酸充满玻璃管的实验目的是将玻璃管中的NO2和空气排出,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致,结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升高度 |
| 1 | 25 | $\frac{2}{3}$ |
| 2 | 50 | 不足试管的$\frac{2}{3}$ |
| 3 | 0 | 液面上升超过实验1 |
②假设反应在标准状况下进行,小试管的容积为VL,将小试管倒立在盛有足量水的水槽中,若溶液溶质不扩散,则得到的溶液的物质的量浓度是$\frac{1}{22.4}$mol/L,若使液体充满试管,应该充入氧气的体积是$\frac{V}{4}$L.
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )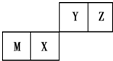

| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2周期第ⅥA族 |
4.常温下,下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
1.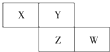 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |
8.下列反应中不属于加成反应的是( )
| A. | 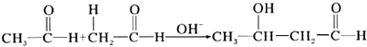 | |
| B. | CH2=CH-CH=CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH-CH3 | |
| C. | 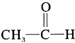 +H2$→_{△}^{催化剂}$CH3-CH-OH +H2$→_{△}^{催化剂}$CH3-CH-OH | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
5. 一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )
 一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )| 选项 | 操作与现象 | 解释与推论 |
| A | 电池放电时化学能转化为电能 | Zn(s)+Cu2+(aq)=Zn2++Cu(s)△H>0 |
| B | 该电池充电时铜棒变细 | 两电极区溶液颜色都变深 |
| C | 该电池放电时铜棒是电池正极 | Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D | 该电池充电时a接电源正极 | 电极反应Cu2++2e-=Cu |
| A. | A | B. | B | C. | C | D. | D |
6.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性.制备时将FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色、分散质粒子直径在5.5nm~36nm的磁流体.下列说法正确的是( )
| A. | 所得的分散系属于胶体,可发生丁达尔效应 | |
| B. | 所得的分散系中,分散质的主要成分为FeO | |
| C. | 该分散系进行电泳实验时,阳极周围黑色加深 | |
| D. | 往油酸钠水溶液中滴加浓溴水振荡,无明显现象 |