题目内容
16. 根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 同质量的同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.5×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究同质量的同种催化剂的比表面积对尾气转化速率的影响 | 280 | 6.5×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.5×10-3 | 4.00×10-3 | 80 |
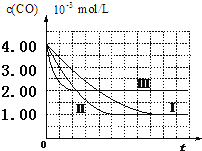
(2)由图可知,第Ⅰ组实验中,CO的平衡浓度为1.00×10-3mol/L,计算达平衡时NO的浓度为3.5×10-3mol/L.
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
分析 (1)实验目的是:探究某些外界条件对汽车尾气转化反应速率的影响规律,应采取控制变量法进行研究,实验I、Ⅱ催化剂比表面积不同,其它条件相同,实验Ⅰ、Ⅲ温度不同,其它条件应相同;不同的条件即为探究该条件对尾气转化速率的影响;
(2)由方程式可知△c(CO)=△c(NO),平衡时NO浓度=NO起始浓度-NO浓度变化量;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,缩短到达平衡的时间,汽车尾气转化速率增大.
解答 解:(1)实验目的是:探究某些外界条件对汽车尾气转化反应速率的影响规律,应采取控制变量法进行研究,实验I、Ⅱ催化剂比表面积不同,其它条件相同,实验Ⅰ、Ⅲ温度不同,其它条件应相同,不同的条件即为探究该条件对尾气转化速率的影响,则:
| 实验编号 | 实验目的 | T/℃ | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 同质量的同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.5×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究同质量的同种催化剂的比表面积对尾气转化速率的影响 | 280 | 6.5×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.5×10-3 | 4.00×10-3 | 80 |
| 实验编号 | 实验目的 | T/℃ | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 同质量的同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.5×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究同质量的同种催化剂的比表面积对尾气转化速率的影响 | 280 | 6.5×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.5×10-3 | 4.00×10-3 | 80 |
(2)由方程式可知△c(NO)=△c(CO)=4.00×10-3mol/L-1.00×10-3mol/L=3.00×10-3mol/L,故平衡时NO浓度=6.5×10-3mol/L-3.00×10-3mol/L=3.5×10-3mol/L,故答案为:3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,缩短到达平衡的时间,汽车尾气转化速率增大,故答案为:增大.
点评 本题考查化学平衡计算、影响外界条件对反应速率的影响等,注意利用控制变量法分析解答,难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
15. 如图为美国布朗大学的科学家使用硅碲化物制造出的新型纳米颗粒材料,可广泛应用于电子和光学设备中.将该纳米颗粒分散到水中,下列有关该分散系的说法中正确的是( )
如图为美国布朗大学的科学家使用硅碲化物制造出的新型纳米颗粒材料,可广泛应用于电子和光学设备中.将该纳米颗粒分散到水中,下列有关该分散系的说法中正确的是( )
 如图为美国布朗大学的科学家使用硅碲化物制造出的新型纳米颗粒材料,可广泛应用于电子和光学设备中.将该纳米颗粒分散到水中,下列有关该分散系的说法中正确的是( )
如图为美国布朗大学的科学家使用硅碲化物制造出的新型纳米颗粒材料,可广泛应用于电子和光学设备中.将该纳米颗粒分散到水中,下列有关该分散系的说法中正确的是( )| A. | 该分散系属于溶液 | B. | 该分散系能产生丁达尔效应 | ||
| C. | 该分散系不能通过滤纸 | D. | 该分散系的隐定性强于食盐水 |
11.回答下列有关重要化工原料甲醇的有关问题
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若起始时投入2molH2、1molCO,反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数约为44.4%(Kp是平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).根据化学反应原理,分析增加压强对制备甲醇反应的影响增大压强使反应体系各组分浓度增大,反应速率加快,正反应为气体物质的量减小的反应,压强增大平衡正向移动,H2、CO的转化率增大,CH3OH的产率增大
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
①$\frac{x}{y}$=$\frac{1}{2}$
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示
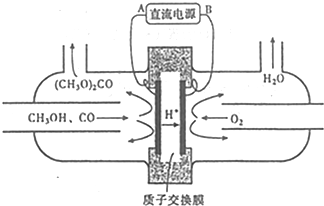
电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示

电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
1.下列叙述中,正确的是( )
| A. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| B. | 油脂是高分子化台物,水解可生成甘油和高级脂肪酸 | |
| C. | 煤中含有的煤焦油,可由煤干馏获得 | |
| D. | 聚乙烯塑料的老化是因为发生了加成反应 |
8.下列说法正确的是( )
| A. | 坩埚主要用于给固体加热,可用坩埚将烧碱加热融化 | |
| B. | 明矾净水原理是吸附,不涉及化学变化 | |
| C. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| D. | SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 |
5.下列各反应中,生成物不随反应条件或反应物用量的变化而变化的是( )
| A. | Na和O2 | B. | Fe和稀HNO3 | C. | Cu和FeCl3溶液 | D. | Na2CO3和稀HCl |