题目内容
14.乙二酸通常以二水合物的形式存在(H2C2O4•2H20),俗称草酸晶体.已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会发生分解反应.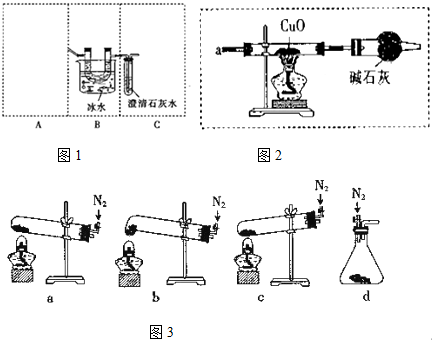
(1)下列关于乙二酸的叙述正确的是①②③.(填序号)
①能和乙二醇发生酯化反应
②其溶液能使蓝色石蕊试纸变红
③能和碳酸钠溶液反应生成气体
(2)欲检验草酸晶体受热分解的产物中是否有 CO2,
设计实验如图1:
图2A装置最好应该选择下列装置图3中的b(填序号)
②简述检验整套装置气密性的操作方法:装置气密性检验,先密闭装置,最后的导气管插入水中,微热后,有气泡冒出,冷却后导气管会有水柱上升,证明装置气密性完好.
③若无如图2B装置,当c装置中出现浑浊不能(填“能”或“不能”)证明草酸分解生成了CO2,
理由是_草酸和氢氧化钙也反应生成草酸钙白色沉淀.
(3)若上述装置C中盛放Ba(OH)2 溶液,导气管与D装置中的a相连,通过测定C中生成沉淀的质量,装置D中硬质玻璃管减少的质量,即可确定草酸分解的化学方程式H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑.
①C中盛放Ba(OH)2 溶液,而不使用澄清石灰水的原因是_Ba(OH)2 溶解度大于氢氧化钙可充分吸收二氧化碳,碳酸钡摩尔质量大于碳酸钙,测量误差小.
②当A装置试管中只有较少晶体时停止加热,利用余热使晶体 升华、分解,此时需要缓缓通入N2,通入N2 的目的是使草酸分解生成的气体全部钡装置CD全部吸收.
③若取草酸晶体的质量为15.0g,C中沉淀的质量为19.7g,装置如图2D中硬质玻璃管减少的质量为1.6g,则草酸分解的化学方程式为H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑.
分析 (1)乙二酸分子中含有羧基,有酸性能发生酯化反应、能被高锰酸钾氧化;
(2)①由于试管口向下倾斜,草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中会出现熔融的草酸流进导管而影响后续实验,能避免熔融的草酸流进导管而影响后续实验;
②装置气密性检验,先密闭装置,最后的导气管插入水中,微热后,有气泡冒出,冷却后导气管会有水柱上升,证明装置气密性完好;
③草酸晶体在101℃时熔化并开始升华,157℃时大量升华,草酸和氢氧化钙也反应生成草酸钙白色沉淀分析;
(3)①C中盛放Ba(OH)2 溶液,而不使用澄清石灰水,氢氧化钡溶解度大于氢氧化钙,利用的是氢氧化钡吸收二氧化碳充分,碳酸钡摩尔质量大于碳酸钙,测得误差小;
②缓缓通入N2,把生成的气体全部赶入CD中全部吸收,减少测得误差;
③若取草酸晶体的质量为15.0g,C中沉淀的质量为19.7g,为碳酸钡沉淀,计算得到二氧化碳中碳元素物质的量,装置D中硬质玻璃管减少的质量为1.6g,说明生成了一氧化碳,依据反应定量关系计算一氧化碳物质的量,依据碳元素守恒得到草酸晶体中草酸质量,得到含有结晶水的质量,依据原子守恒计算书写化学方程式;
解答 解:(1)乙二酸分子中含有羧基,具有酸性,且酸性比碳酸强,能使蓝色石蕊试液变红,能与碳酸氢钠反应生成二氧化碳;能与乙二醇发生发生酯化反应,所以三个选项都正确,
故答案为:①②③;
(2)①由于试管口向下倾斜,草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中会出现熔融的草酸流进导管而影响后续实验,能避免熔融的草酸流进导管而影响后续实验,装置最好应该选择下列装置中的b,
故答案为:b;
②装置气密性检验,先密闭装置,最后的导气管插入水中,微热后,有气泡冒出,冷却后导气管会有水柱上升,证明装置气密性完好,如图连接好装置,关闭装置A的活塞,将C装置中的导管没入水中,微热A装置的试管,看到导气管口处有气泡冒出,撤火后观察到导气管中有一段水柱上升,则说明装置气密性完好,
故答案为:装置气密性检验,先密闭装置,最后的导气管插入水中,微热后,有气泡冒出,冷却后导气管会有水柱上升,证明装置气密性完好;
③草酸晶体在101℃时熔化并开始升华,157℃时大量升华,草酸和氢氧化钙也反应生成草酸钙白色沉淀分析,若无B装置,当c装置中出现浑浊,不能说明草酸分解生成了CO2,
故答案为:不能;草酸和氢氧化钙也反应生成草酸钙白色沉淀;
(3)①C中盛放Ba(OH)2 溶液,而不使用澄清石灰水,氢氧化钡溶解度大于氢氧化钙,利用的是氢氧化钡吸收二氧化碳充分,碳酸钡摩尔质量大于碳酸钙,测得误差小,
故答案为:Ba(OH)2 溶解度大于氢氧化钙可充分吸收二氧化碳,碳酸钡摩尔质量大于碳酸钙,测量误差小;
②缓缓通入N2,把生成的气体全部赶入CD中全部吸收,减少测得误差,
故答案为:使草酸分解生成的气体全部钡装置CD全部吸收;
③若取草酸晶体的质量为15.0g,C中沉淀的质量为19.7g,为碳酸钡沉淀物质的量=$\frac{19.7g}{197g/mol}$=0.1mol,计算得到二氧化碳中碳元素物质的量为0.1mol,装置D中硬质玻璃管减少的质量为1.6g,减少的是氧元素质量,物质的量=$\frac{1.6g}{16g/mol}$=0.1mol,依据反应定量关系计算一氧化碳物质的量,说生成了一氧化碳为0.1mol,依据碳元素守恒得到草酸晶体中草酸质量=(0.1mol+0.1mol)×$\frac{1}{2}$×90g/mol=9g,得到含有结晶水的质量=15g-9g=6g,水的物质的量=$\frac{6g}{18g/mol}$=$\frac{1}{3}$mol,n(CO2):n(CO):n(H2O)=0.1:0.1:$\frac{1}{3}$≈1:1:3,依据原子守恒计算书写化学方程式:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑,
故答案为:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+3H2O+CO↑.
点评 本题通过探讨乙二酸的性质,考查了物质性质实验方案的设计,题目难度较大,正确理解题干信息明确反应原理为解答关键,计算过程稍复杂,可以假设出草酸氢铵的物质的量,然后根据反应原理计算,试题充分考查了学生的分析、理解能力及化学实验、化学计算能力,题目难度中等.

| A. | 升高温度 | B. | 增加Y的用量 | C. | 减小压强 | D. | 使用催化剂 |
| A. | NaFeO4 | B. | Na2FeO4 | C. | NaFe2O4 | D. | Na2Fe3O8 |
| A. | 纳米铜能在氧气中燃烧,说明了纳米铜比普通铜的还原性强 | |
| B. | 白色污染与塑料垃圾有关 | |
| C. | 臭氧空洞的形成与化石燃料大量使用有关 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
| A. | 取代反应 | B. | 加成反应 | C. | 聚合反应 | D. | 置换反应 |
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 在铁制品上镀铜时,石墨为阳极,铁制品作阴极,铜盐为电镀液 | |
| C. | 用锡焊接的铁质器件,焊接处易生锈 | |
| D. | 燃气灶上的炒锅支架容易生锈,主要是由于高温下铁易发生“化学腐蚀” |
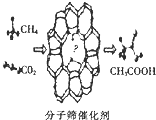 我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )| A. | 消耗22.4 LCO2可制得1mol乙酸 | |
| B. | 该反应属于取代反应 | |
| C. | 反应物和生成物中均含有极性键和非极性键 | |
| D. | 该反应过程符合“绿色化学”原理,其原子利用率为100% |
 根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 同质量的同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.5×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究同质量的同种催化剂的比表面积对尾气转化速率的影响 | 280 | 6.5×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.5×10-3 | 4.00×10-3 | 80 |
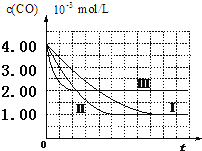
(2)由图可知,第Ⅰ组实验中,CO的平衡浓度为1.00×10-3mol/L,计算达平衡时NO的浓度为3.5×10-3mol/L.
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).