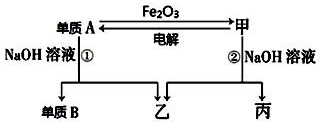
题目内容
8.下列说法正确的是( )| A. | 坩埚主要用于给固体加热,可用坩埚将烧碱加热融化 | |
| B. | 明矾净水原理是吸附,不涉及化学变化 | |
| C. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| D. | SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 |
分析 A、坩埚的材质是陶瓷,成分中含二氧化硅;
B、明矾水解出氢氧化铝胶体,有吸附功能;
C、合成纤维是有机非金属材料,光导纤维是新型无机非金属材料;
D、SO2与FeSO4均有强还原性.
解答 解:A、瓷坩埚为硅酸盐产品,含有二氧化硅,在加热条件下与NaOH反应而使坩埚炸裂,故A错误;
B、明矾溶于水,铝离子水解生成氢氧化铝胶体,有新物质生成,属于化学变化,故B错误;
C、合成纤维是有机非金属材料,是有机高分子化合物,而光导纤维是二氧化硅,是新型无机非金属材料,故C错误;
D、SO2与FeSO4均有强还原性,均能使高锰酸钾溶液被还原而褪色,原理相同,故D正确.
故选D.
点评 本题考查了硅性质的应用,高分子化合物的判断,生活中有机物的分类结构和性质应用判断,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.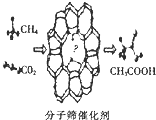 我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
 我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )| A. | 消耗22.4 LCO2可制得1mol乙酸 | |
| B. | 该反应属于取代反应 | |
| C. | 反应物和生成物中均含有极性键和非极性键 | |
| D. | 该反应过程符合“绿色化学”原理,其原子利用率为100% |
16. 根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
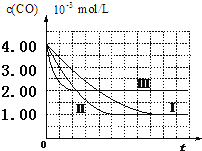
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图如下:
(2)由图可知,第Ⅰ组实验中,CO的平衡浓度为1.00×10-3mol/L,计算达平衡时NO的浓度为3.5×10-3mol/L.
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
 根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 同质量的同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.5×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究同质量的同种催化剂的比表面积对尾气转化速率的影响 | 280 | 6.5×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.5×10-3 | 4.00×10-3 | 80 |
(2)由图可知,第Ⅰ组实验中,CO的平衡浓度为1.00×10-3mol/L,计算达平衡时NO的浓度为3.5×10-3mol/L.
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
3.设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 1molCl2参加反应转移电子数一定为2NA | |
| B. | 1mol甲烷分子所含质子数为10NA | |
| C. | 0.1molFe粉与足量水蒸气反应生成H2分子数为0.1NA | |
| D. | 含0.4molAl3+的Al2(SO4)3中含SO42-的物质的量是0.6NA |
18.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:
①3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.则下列叙述正确的是( )
①3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.则下列叙述正确的是( )
| A. | 反应②属于离子反应 | |
| B. | 若制取等量的Si3N4,则反应①②转移电子数目必然相等 | |
| C. | 反应①的氧化剂是N2 | |
| D. | 反应①中氧化产物与还原产物物质的量之比为1:6 |
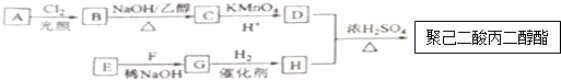
 $\stackrel{△}{→}$
$\stackrel{△}{→}$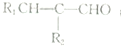
 .
. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图(不能超过5步).
)的合成路线示意图(不能超过5步).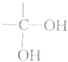 →
→ +H2O
+H2O