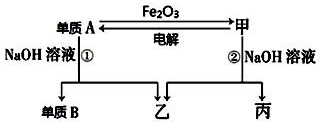
题目内容
6.现有下列三组溶液:①20℃时1mL 0.1mol•L-1的Na2S2O3溶液和1mL 0.1mol•L-1的H2SO4溶液;
②10℃时1mL 0.2mol•L-1的Na2S2O3溶液和9mL0.05mol•L-1的H2SO4溶液;
③10℃时1mL 0.1mol•L-1的Na2S2O3溶液和1mL 0.1mol•L-1的H2SO4溶液.
若同时将它们混合发生反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,则出现浑浊的先后顺序是( )
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ①③② |
分析 对于反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O来说,温度越高、浓度越大,则反应速率就越快,在实验中就最先出现浑浊,以此解答该题.
解答 解:①反应温度最高,则速率最大,②③相比较,温度相同,③浓度较大,则③反应速率较大,所以反应速率由大到校的顺序为①③②,
故选D.
点评 本题考查影响化学反应速率的因素,明确温度和浓度对化学反应速率的影响即可解答,注意利用习题中的数据来比较温度和浓度.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
16.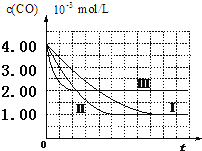 根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图如下:
(2)由图可知,第Ⅰ组实验中,CO的平衡浓度为1.00×10-3mol/L,计算达平衡时NO的浓度为3.5×10-3mol/L.
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
 根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 同质量的同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.5×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究同质量的同种催化剂的比表面积对尾气转化速率的影响 | 280 | 6.5×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.5×10-3 | 4.00×10-3 | 80 |
(2)由图可知,第Ⅰ组实验中,CO的平衡浓度为1.00×10-3mol/L,计算达平衡时NO的浓度为3.5×10-3mol/L.
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
14.在1L密闭容器中通入2mol 氨气,在一定温度下发生反应:2NH3?N2+3H2,达平衡时,N2的物质的量分数为a%,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a%的是( )
| A. | 3 mol H2和1 mol N2 | |
| B. | 2 mol NH3和1 mol N2 | |
| C. | 2 mol N2和3 mol H2 | |
| D. | 0.1 mol NH3、0.9 mol N2、2.85 mol H2 |
1.金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B$\frac{\underline{\;加热\;}}{\;}$A2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g.有关实验数据记录如下.试求丙学生实验中a:b的值可能是多少?
| A的用量 | B的用量 | A2B的质量 | |
| 甲 | 7.0 g | 1.0 g | 5.0 g |
| 乙 | 4.0 g | 4.0 g | 5.0 g |
| 丙 | a g | b g | 3.0 g |
11.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1.下列有关X的说法中不正确的是( )
| A. | X能与某些非金属元素化合 | |
| B. | X可能为金属元素 | |
| C. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| D. | X可能形成化学式为KXO3的盐 |
18.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:
①3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.则下列叙述正确的是( )
①3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.则下列叙述正确的是( )
| A. | 反应②属于离子反应 | |
| B. | 若制取等量的Si3N4,则反应①②转移电子数目必然相等 | |
| C. | 反应①的氧化剂是N2 | |
| D. | 反应①中氧化产物与还原产物物质的量之比为1:6 |
15.在下列反应中,生成物的能量总和高于反应物的能量总和且表述正确的是( )
| A. | Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2↑(g)△H<0 | B. | 2CO(g)+O2(g)═2CO2(g)△H<0 | ||
| C. | C(s)+CO2(g)═2 CO(g)△H>0 | D. | H+(aq)+OH-(aq)═H2O (l)△H>0 |
16.已知①向KI溶液中通入过量Cl2会有KIO3生成;②向酸化的KI与KIO3混合液中滴加淀粉溶液会变蓝色.下列有关说法正确的是( )
| A. | Iˉ只有还原性,IO32-只有氧化性 | |
| B. | 由①②可知氧化性的强弱顺序为Cl2>I2>IO32- | |
| C. | ①中发生反应的离子方程式为:3Cl2+Iˉ+3OHˉ=IO32-+6Clˉ+3H+ | |
| D. | 反应②中若有5mol电子转移,则生成3mol单质I2 |